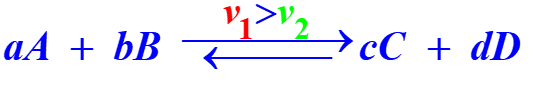Evolution Spontanée Chimie
ACTIVITES
A1 : Equilibre chimique dynamique.
Pour tester si la réaction entre les ions argent (I) et les ions Fer (III) est totale ou non, on développe une méthode expérimentale spécifique.
Objectif : Associer la présence de tous les réactifs à l’état final au caractère non total de la réaction.
|
Doc 3 : Protocole : influence de la composition initiale. • Préparer chacun des mélanges suivants dans trois béchers distincts.
• Pour chaque mélange, verser quelques millilitres dans des tubes à essai et effectuer les trois tests de présence des ions décrits dans le Doc 1. |
|
|
· Ecrire la réaction d'oxydoréduction entre l'ion Ag+ et l'ion Fe3+.
· Pour chacun des mélanges, calculer les quantités de matières de réactifs introduites et identifier le réactif limitant.
· Réaliser le protocole du document 3. Pour chaque mélange, indiquer grâce aux résultats des tests, les espèces chimiques présentes dans l’état final (document 1).
· Est-ce cohérent avec l’hypothèse d’une réaction totale ?
· La composition initiale du mélange a-t-elle une influence sur la nature des espèces présentes à l’état final ?
· Indiquer dans l’écriture de l’équation le symbole adapté (document 4).
· La réaction inverse est possible. Ecrire cette réaction et proposer un protocole pour mettre en évidence les produits formés.
Expliquer pourquoi on a choisi une flèche "double".
· Expliquer pourquoi la présence de tous les réactifs dans l’état final prouve que la réaction n’est pas totale.
· Quelle relation peut-on écrire en tre l’avancement final et l’avancement maximal pour une réaction totale ? pour une réaction non totale ?
A2 : Constante d’équilibre d’une réaction chimique.
L’acide éthanoïque, ou acide acétique, tire son nom de sa présence dans le vinaigre (acetum en latin).
On cherche à caractériser sa réaction avec l’eau, qui provoque une diminution du pH.
Objectif : Déterminer l’influence de la composition de l’état initial sur le quotient de réaction à l’état final.
|
Protocole 1 : Dilutions de la solution d’acide éthanoïque A partir d’une solution mère, appelée S1, d’acide éthanoïque de concentration c1 = 1,0.10-1 mol.L-1, préparer : • Une solution fille S2 de concentration c2 = 1,0.10-2 mol.L-1 . • Une solution fille S3 de concentration c3 = 5,0.10-3 mol.L-1. |
|
Protocole 2 : Dilutions de la solution d’acide éthanoïque • Dans trois béchers, verser environ V = 30 mL des solutions 1, 2 et 3. • Mesurer le pH de chaque solution au dixième d’unité pH près. • Compléter le tableau suivant avec les valeurs de pH mesurées pour chaque solution.
|
|
|
1. Réaliser les protocoles 1 et 2.
2. Calculer pour chaque solution la concentration [H3O+] en ions oxonium et l’indiquer dans le tableau du protocole 2.
3a. Ecrire l’équation de la réaction entre l’acide éthanoïque et l’eau.
3b. Pour une concentration apportée c en acide éthanoïque et un volume V de solution, construire le tableau d’avancement en notant xéq l’avancement à l’équilibre. En déduire la relation entre la concentration [H3O+] en ions oxonium à l’équilibre, le volume V et xéq.
3c. Déduire de la relation précédente qu’à l’équilibre :
[CH3CO2H] = c - [H3O+]eq et [CH3CO2- ] = [H3O+]eq
3d. Compléter les deux dernières colonnes du tableau du protocole 2.
4a. Donner l’expression du quotient Qr,éq à l’état final (état d’équilibre) en fonction des différentes concentrations à l’équilibre.
4b. Calculer la valeur de Qr,éq pour chaque solution. En déduire la valeur epérimentale de la constante d’équilibre K.
5. Calculer le taux d’avancement final $ \tau_f = \dfrac {x_{éq}}{x_{max}} $ pour chaque solution.
Bilan
• La composition de la solution à l’état final dépend-elle de la composition initiale ?
• Le quotient de réaction à l’état final dépend-il de la composition initiale ?
• Le taux d’avancement final dépend-il de la composition initiale ?
A3 :Transfert spontané d’électrons.
Une pile électrochimique convertit l’énergie chimique en énergie électrique en canalisant le transfert d’électrons associé à une réaction d’oxydoréduction.
Objectif : Mettre en évidence le transfert spontané d’électrons et les transformations électrochimiques associées, Exploiter ces résultats pour fabriquer une pile.
|
Protocole 1 : Système Fe(s) et Cu2+(aq) au contact
• Dans un tube à essais, introduire 5 mL de la solution de sulfate de cuivre et ajouter deux spatulées de poudre en fer. • Boucher et agiter énergétiquement le tube à essais. • Laisser décanter. Observer le dépôt de cuivre sur la surface du fer. • Transvaser 2 mL de la solution obtenue dans un tube à essais et ajouter la solution d’hydroxyde de sodium. Observer le précipité formé. Sa couleur verdâtre est révélatrice de la présence d’ions Fe2+ dans la solution. |
|
Protocole 2 : Système Fer et cuivre séparés.
• Dans un bécher de 100 mL, verser environ 50 mL de la solution de sulfate de cuivre et introduire la lame de cuivre. • Dans un second bécher de 100 mL, verser environ 50 mL de la solution de sel de Mohr et introduire la lame de fer. • Placer le pont salin de telle sorte qu’il trempe dans les deux solutions. Une pile est formée. • Placer un voltmètre entre les deux plaques. Mesurer la tension à vide U0 entre les lames. Inverser éventuellement les bornes du voltmètre pour obtenir une valeur positive. • Remplacer le voltmètre par un ampèremètre en série avec un dipôle ohmique et mesurer la valeur I de l’intensité du courant. Inverser éventuellement les bornes pour obtenir une valeur positive. • Observer l’évolution de l’intensité I au cours du temps et de la coloration de la solution de sulfate de cuivre.
|
|
Doc1 : Matériels et produits • Tubes à essais, 2 béchers de 100 mL, • Poudre de fer • Pont salin • Solution d’hydroxyde de sodium concentrée. • Solution de sel de Mohr de concentration en Fe2+ c = 0,10 mol.L-1, • Solution de sulfate de cuivre de concentration c = 0,10 mol.L-1, • Voltmètre, ampèremètre et dipôle ohmique de résistance R = 10 Ω • Lame de fer et lame de cuivre. |
• Réaliser le protocole 1. A l’aide des observations, écrire la réaction chimique se produisant dans le système contenant du fer et des ions cuivre au contact.
• Réaliser le protocole 2. Déduire du sens de branchement du voltmètre la polarité de la pile. Déduire du sens de branchement de l’ampèremètre le sens du courant et le sens des électrons dans le circuit.
• Les couples mis en jeu sont Cu2+/Cu et Fe2+/Fe, en déduire les demi-équations au niveau de chaque lame métallique, et vérifier la cohérence de ces demi-équations avec toutes les observations faites au cours du fonctionnement de la pile.
Bilan
• La réaction d’oxydoréduction est-elle la même dans les deux protocoles ?
• Réaliser un schéma de la pile faisant apparaitre les transformations chimiques dans chaque bécher et le mouvement des électrons, le sens du courant extérieur et le mouvement des ions dans le pont salin.
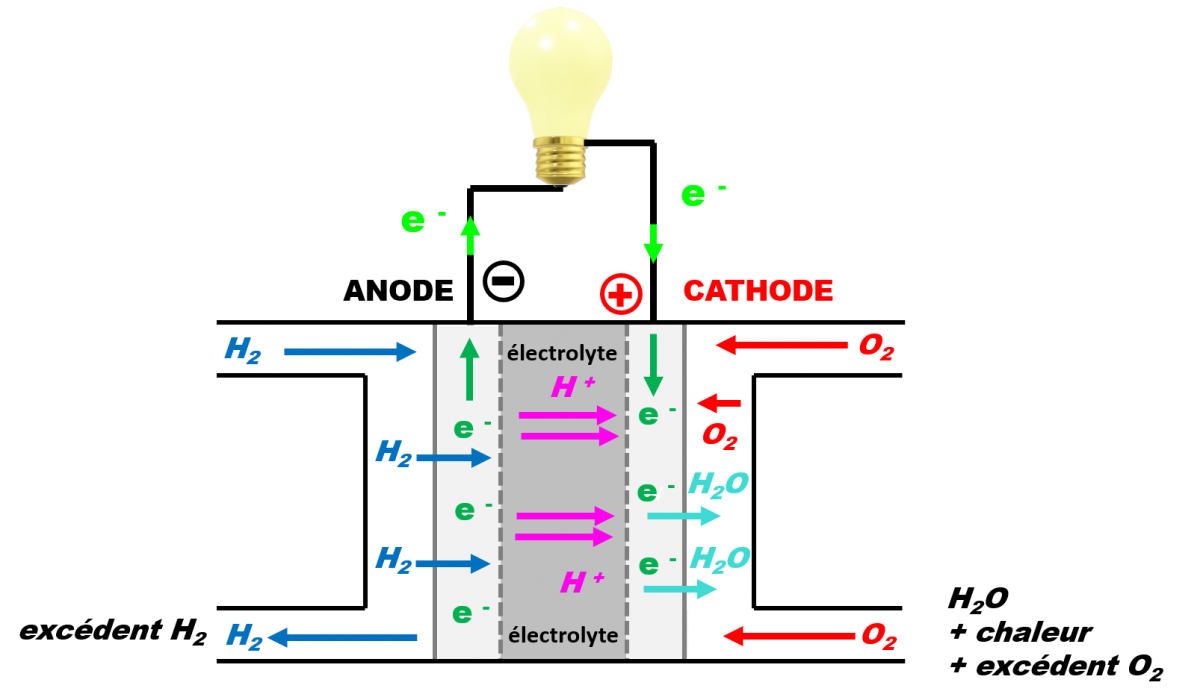
A4 : L’avenir de la pile à combustible.
Le projet de loi sur la mobilité envisage de supprimer les moteurs thermiques, à l’horizon 2040. Cela peut être facilité par le développement des piles à combustibles qui pourront équiper les véhicules électriques.
Objectif : Evaluer les avantages et les inconvénients de la pile à combustible.
|
Doc1 : Schéma de la pile à combustible : |
|
Doc2 : Caractéristiques de véhicules.
|
|
Doc3. : Production du dihydrogène "Aujourd’hui, 95 % de l’hydrogène est produit à partir d’hydrocarbures (pétrole, gaz naturel et charbon), solution la moins coûteuse. Cependant, ce processus est émetteur de CO2, gaz à effet de serre. Les industriels envisagent de plus en plus de produire l’hydrogène […] en recourant à des énergies décarbonées. L’enjeu reste toutefois le coût de ce mode de production bien plus onéreux à ce jour que celui du réformage." Propos de Guy Maisonnier , ingénieur économiste |
|
Doc4 : Vocabulaire. Membrane : interface équivalente au pont salin permettant le passage des ions et des gaz entre les électrodes. Elle est souvent en fluoropolymère. |
Questions :
· Fonctionnement de la pile à combustible (doc 1)
- Quelles sont les espèces chimiques qui réagissent lors du fonctionnement de la pile ? Quelles sont celles qui sont rejetées ?
- Ecrire l’équation de fonctionnement de la pile. En déduire les demi-équations aux électrodes. Indiquer quelles espèces traversent la membrane
· Avantages et inconvénients de la pile à combustible (documents 2 et 3)
- Pour les questions suivantes, on pourra s’aider d’un moteur de recherche en complément des documents fournis.
- Quelles sont les sources de dihydrogène utilisées ?
- Quel risque présente un réservoir de dihydrogène dans une voiture ?
- Quel problème peut poser la membrane lors de son retraitement ?
- Quel gaz à effet de serre n’est pas rejeté par les piles à combustible ?
Bilan :
- Construire un tableau présentant les avantages et inconvénients d’un véhicule utilisant une pile à combustible (sans mettre de valeurs)
- L’utilisation de la pile à combustible semble-t-elle déjà d’actualité ?
EXERCICES : 13,17,19,21,22,24,et 26 P 147 à 149
COURS
C1 : Equilibre chimique.
C11. Réactions totales et non totales.
On considère une transformation chimique : $aA + bB \longrightarrow cC + dD $
· Si l'un des réactifs (A ou B) a totalement disparu à l'état final, il s'agit d'une réaction totale.
Ce réactif est le réactif limitant.
L'avancement final de la réaction est alors maximal : xf = xmax.
· Dans le cas contraire, à l'état final, les réactifs et les produits sont tous présents. La réaction est non totale.
L'avancement final est alors inférieur à l'avancement maximal : xf < xmax.
|
Taux d'avancement : C'est la grandeur t mesurant le rapport de la quantité de réactif ayant réagit : $\color{red}{\tau = \dfrac {x_{éq}}{x_{max}}}$ (sans dimension) |
C12. Equilibre dynamique.
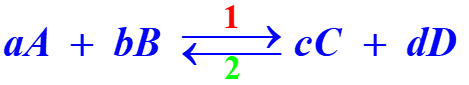
• Dans le cas d'une réaction non totale, la réaction est notée :
- La réaction a lieu simultanément dans les deux sens 1 et 2.
- La réaction directe 1 (entre les réactifs A et B) est compensée par la réaction indirecte 2 (entre les produits C et D).
| •Au niveau microscopique, initialement, la vitesse v1 dans le sens direct est supérieure à la vitesse v2 dans le sens indirect. Au cours du temps, les deux vitesses varient jusqu'à atteindre un moment où v1 = v2. L'équilibre est alors atteint. |
Avant l'équilibre :
A l'équilibre : |
C13. Quotient de réaction et constante d'équilibre.
|
Définition : A chaque réaction chimique $\color{blue}{aA+bB \overrightarrow{\longleftarrow} cC+dD}$, on définit le quotient de réaction QR, sans dimension : $\color{red}{Q_R=\dfrac {[C]^c \times [D]^d}{[A]^a \times [B]^b}}$ où [X] est la concentration molaire volumique de l'espèce X, en mol.L-1. |
NB : si l'espèce X est un solvant, un gaz non dissous ou un solide, sa concentration n'est pas définie. La grandeur [X] prend alors la valeur 1.
Dans le cas d'une réaction chimique, les concentrations évoluent. Le coefficient QR évolue donc aussi, jusqu’à se stabiliser à l'état d'équilibre. Il prend alors la valeur K(T), appelée constante d'équilibre :
|
Définition : $\color{red}{K(T)=\dfrac {[C]^c_f \times [D]^d_f}{[A]^a_f \times [B]^b_f}}$ |
où [X]f est la concentration molaire volumique de l'espèce X, en mol.L-1 à l'état final.
NB : Cette constante varie avec la température.
C14.Critère d'évolution.
• Dans le cas d'une réaction non totale, la réaction est notée :
- La réaction a lieu simultanément dans les deux sens 1 et 2.
- La réaction directe 1 (entre les réactifs A et B) est compensée par la réaction indirecte 2 (entre les produits C et D).
|
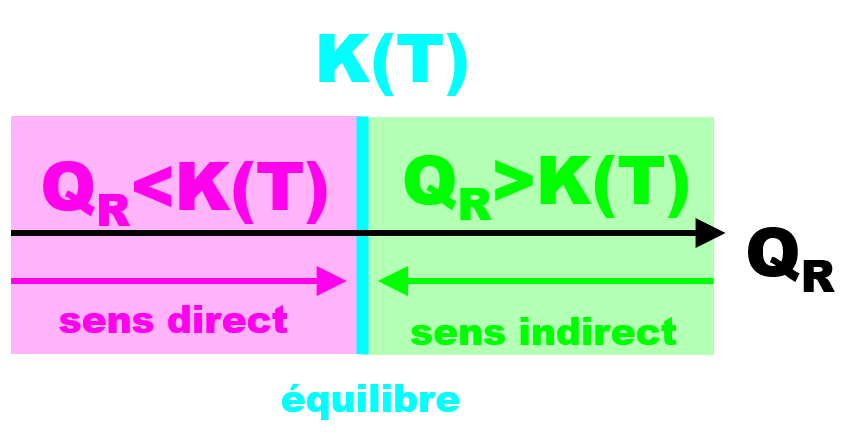
• Tant que QR < K(T), le système évolue dans le sens direct de la réaction. [C] et [D] augmentent tandis que [A] et [B] diminuent.
• Si QR > K(T), le système évolue dans le sens indirect de la réaction. [C] et [D] diminuent tandis que [A] et [B] augmentent.
• Si que QR = K(T), le système n'évolue plus, le système est à son état d'équilibre. [C] , [D] , [A] et [B] ne varient plus et ont atteint leurs valeurs finales [C]f , [D]f , [A]f et [B]f. |
C2. Les piles.
C21. Constitution d'une pile électrochimique.
C21a.Rappel.
|
Lorsqu'une réaction d'oxydo-réduction se produit spontanément, si l'oxydant Ox1 est au contact du réducteur Red2, l'échange d'électrons est direct.
ci-contre, de la poudre en fer (gris) dans une solution d'ions cuivre II bleue. La réaction observée : $Cu^{2+}_{(aq)} + Fe \overrightarrow{\longleftarrow} Cu_{(s)} + Fe^{2+}_{(aq)}$ On observe un dépôt de cuivre rouge à la surface du fer, la disparition des ions Cu2+ et l'apparition des ions Fe2+ entraine un changement de couleur de la solution |
 |
C21b. Mise en place.
|
La pile électrochimique est constituée : · Deux demi-piles, chacune comportant :
· Un pont salin contenant des ions inertes vis-à-vis des couples des deux demi-piles.
NB : Le fait que les deux espèces agissant dans la réaction ne soient pas en contact implique la non-circulation des électrons dans que le pont salin n'est pas en place. Le courant électrique ne circule pas. |
Pile Cu/Zn |
La valeur mesurée par le voltmètre indique le potentiel à vide de la pile, exprimé en volts (V).
C22. Fonctionnement d'une pile électrochimique.
|
Dès lors que les deux demi-piles sont reliées, le courant électrique circule de l'une vers l'autre. La réaction d'oxydo-réduction peut avoir lieu. Les électrons circulent via le circuit externe et les ions circulent via le pont salin assurant ainsi la neutralité électrique des solutions.
A la borne positive, il y a réduction de l'oxydant Ox1 : $Ox_1 + n \ e^- \overrightarrow{\longleftarrow} Red_1$ A la borne négative, il y a oxydation du réducteur Red2 : $Red_2\overrightarrow{\longleftarrow} Ox_2 + m \ e^- $ Le courant électrique circule de la borne positive à la borne négative. Les électrons circulent dans l'autre sens. |
 |
C23. Usure d'une pile électrochimique.
Dans le cas de la pile ci-dessus, la borne positive est au cuivre.
• L'électrode de cuivre trempe dans une solution de sulfate de cuivre $\left ( Cu^{2+}_{(aq)} ; SO^{2-}_{4(aq)} \right )$ .
La demi-équation observée est : $ Cu^{2+}_{(aq)} + 2 e^- \overrightarrow{\longleftarrow} Cu_{(s)}$ .
On observe un dépôt de cuivre sur l'électrode de cuivre.
Les ions Cu2+ sont consommés.
• L'électrode de zinc trempe dans une solution de sulfate de zinc $\left ( Zn^{2+}_{(aq)} ; SO^{2-}_{4(aq)} \right )$ .
La demi-équation observée est :$Zn_{(s)}\overrightarrow{\longleftarrow} Zn^{2+}_{(aq)} + 2 e^- $ .
L'électrode de zinc est consommée.
Des ions Zn2+ formés.
Réaction globale : $Cu^{2+}_{(aq)} + Zn_{(s)}\longrightarrow Cu_{(s)} + Zn^{2+}_{(aq)} $
La pile cessera de produire du courant :
• Soit quand il n'y aura plus de cuivre.
• Soit quand il n'y aura plus d'ion Zn2+.
C24. Lien avec le coefficient de réaction.
Considérons la pile ci-dessus avec des concentrations égales en ions $Zn^{2+}_{(aq)} $ et $Cu^{2+}_{(aq)} $.
La constante d'équilibre de la réaction $Cu^{2+}_{(aq)} + Zn_{(s)}\longrightarrow Cu_{(s)} + Zn^{2+}_{(aq)} $ est K(25°C) = 1,9.1037.
Au départ, le coefficient de réaction vaut : $ Q_R= \dfrac{[Zn^{2+}]}{[Cu^{2+}]} = 1 \ll K (25°C) $ .
La réaction a lieu dans le sens direct jusqu'à la disparition du zinc.
C25. Capacité d'une pile.
|
La capacité d'une pile Q est égale à la charge électrique qui circule pendant la durée complète de fonctionnement de la pile, de l'état initial à son usure complète. Q = I x Δt Q en coulombs, I en Ampères, Δt en secondes. |
Cette grandeur dépend des quantités de réactifs disponibles à l'intérieur de la pile.
Exemple :
Pour la pile ci-dessus, avec une concentration initiale [Zn2+] = 0,2 mol.L-1 dans laquelle le réactif limitant serait le zinc Zn. La transformation d'un atome de zinc libère électrons.
Lorsque tous les ions zinc ont réagi, la quantité de matière en électrons ayant circulé est :
n(e-) = 2 x 0,2 = 0,4 mol .
La capacité électrique de la pile est :
Qmax = n(e-) x Na x e = 0,4 x 6,02.1023 x 1,60.10-19 = 3,86.104 C
Ajouter un commentaire