Premier Principe de la Thermodynamique
PREMIER PRINCIPE DE LA THERMODYNAMIQUE
ACTIVITES
A1. Modes de transfert thermique.
Un système dont la température évolue échange de l'énergie avec l'extérieur sous forme de transfert thermique. Quels sont les différents types de transfert thermique ?
|
Doc1 : Conduction thermique.
|
|
Doc1 : Conduction thermique.
|
|
Doc 3 : Les trois modes de transferts thermiques. · La conduction thermique : L'énergie thermique, du fait de l'agitation thermique au niveau microscopique, se transmet de proche en proche sans transport de matière. · La convection thermique : L'énergie thermique se transmet de proche en proche dans la matière avec déplacement de celle-ci. · Le rayonnement : L'énergie thermique est transmise sans support de matière par rayonnement. |
|
Doc 4 : Situations du quotidien.
|
ANALYSER.
• Décrire les mouvements des particules de matière, lors d'une convection et lors d'une conduction.
RAISONNER.
• Quelle est la particularité du transfert thermique lors d'un rayonnement ?
• En vous basant sur les documents, identifier les transferts thermiques mis en jeu dans les différentes situations, faire une description rapide de chaque type de transfert.
A2. Capacité thermique.
|
Doc 1 : Protocole expérimental pour déterminer la capacité thermique d'un calorimètre. • Verser 200 g d'eau initialement chauffée à une température $T_C$ dans 100 g d'eau à température ambiante $T_{amb}$ contenu dans un calorimètre. • Mélanger puis ajouter le contenu du calorimètre dont le couvercle est fermé jusqu'à ce que la température finale $T_F$ se stabilise. • Si le calorimètre est parfaitement isolé, le système (eau + calorimètre) n'échange aucune énergie avec l'extérieur. |
|
Doc 2 : Protocole expérimental pour déterminer la capacité thermique d'un matériau. • Placer une masse $m$ de ce matériau initialement plongé dans une eau bouillante à 100 °C dans 200 g d'eau à température ambiante $T_{amb}$ contenu dans un calorimètre. • Mélanger puis agiter le contenu du calorimètre dont le couvercle est fermé jusqu'à ce que la température finale $T_F$ se stabilise. • L'énergie reçue alors par le système (eau + calorimètre) provient du matériau.
|
|
Doc3 : Transfert thermique, capacité et variation de l'énergie interne. Pour un système incompressible, la variation d'énergie interne s'écrit : $\Delta U \ = \ Q \ = \ C \times \Delta T$. où : C est la capacité thermique massique : $C \ = \ m \times c$ en J.K-1. $m$ : masse en kg $c$ : capacité thermique massique en J.kg-1.K-1. |
Donnée : la capacité thermique massique de l'eau a pour valeur : $c_{ \ eau} \ = \ 4180 \ J.kg^{ \ -1}.K^{ \ -1}$
A21. Capacité du calorimètre.
REALISER
$\bullet$ Mettre en œuvre le protocole du doc1. permettant de déterminer la capacité thermique du calorimètre $C_{calo}$ en prenant soin de noter les températures $T_{amb}, \ T_{finale}, \ et \ T_{chaud}$ .
$T_{amb} \ =\ ......... , \ T_{finale} \ = \ ........ \ et \ T_{chaud} \ = \ ......$
Analyser-Raisonner.
$\bullet$ Effectuer l'étude énergétique $\left ( eau_{froid} \ + \ calorimètre \ + \ eau_{chaud} \right )$.
Réaliser.
$\bullet$ En déduire la valeur de la capacité du calorimètre $C_{calo}$.
A22. Capacité du matériau.
REALISER
$\bullet$ Mettre en œuvre le protocole du doc2. permettant de déterminer la capacité thermique du calorimètre $C_{calo}$ en prenant soin de noter les températures $T_{amb}$ et $T_{finale}$.
$T_{amb} \ = \ .......... \ , \ T_{finale} \ = \ ........ \ , \ T_{chaud} \ = \ ..........$
Analyser-Raisonner.
$\bullet$ Effectuer l'étude énergétique (eau + calorimètre + matériau).
Réaliser.
$\bullet$ En déduire la valeur de la capacité du calorimètre $C_{mat}$.
A3. Loi de refroidissement.
Une boisson chaude laisser à l'air libre refroidit jusqu'à atteindre la température ambiante.
Peut-on décrire ce processus par un modèle mathématique et prévoir la durée du refroidissement ?
|
Doc 1 : Protocole expérimental.
Afin d'étudier l'expérience sur une durée la plus courte possible, on utilise une petite quantité d'eau qu'on prend à une température de plusieurs dizaines de degrés au-dessus de la température ambiante. • Mettre l'eau dans un récipient et porter sa température à 100 °C. • Relier le capteur de température à un ordinateur et plonger le capteur dans l'eau chaude. |
|
Doc2 : L'hypothèse de Newton.
|
|
Doc3 : Mesures. On mesure la température de la quantité d'eau à la température initiale $T_0 \ = \ 100^{\ o}C $ au cours du temps dans une pièce à la température ambiante $T_{amb} \ = \ 20^{ \ o}C$.
|
Réaliser.
• A l'aide du logiciel Regressi, modéliser l'évolution temporelle de la température sous forme d'une fonction exponentielle : $T(t) \ = \ A \times e^{\ - kt} \ + \ B$.
• Identifier alors, les coefficients $A$, $B$ et $k$.
• Utiliser cette modélisation pour déterminer la température au bout de 4 minutes et 10 minutes. Comparer ces valeurs à celles mesurées.
Analyser/Raisonner.
• Utiliser cette modélisation pour déterminer le temps pour lequel la température sera de 1°C supérieure à celle de la température ambiante.
• Utiliser cette modélisation pour déterminer la température finale du système.
Exercices : 15, 16, 18, 19, 20, 21, 25, 27 et 28 pages 409 à 412.
COURS.
C1. Transferts et flux thermiques.
C11. Modes de transferts thermiques.
Il existe trois modes de transferts thermiques :
- La conduction : l'énergie se propage dans un milieu matériel grâce à l'agitation thermique des particules, qui se transmet de proche en proche.
C'est un transfert thermique par contact entre le système et l'extérieur.
- La convection : l'énergie est transportée par les déplacements du fluide lui-même. Elle peut être naturelle si seule la dilatation et la gravité déplacent le fluide ou forcée si le fluide est poussé à se déplacer.
C'est un transfert thermique entre le système et l'extérieur par mouvement de matière au sein du système.
- Le rayonnement : tout corps porté à une certaine température émet des ondes électromagnétiques qui peuvent augmenter l'énergie interne d'autres corps à distance.

C12. Sens de transfert thermique.
|
Un transfert thermique ne peut se faire que dans un seul sens : il ne peut avoir lieu que d'un milieu qui a la température la plus élevée vers un milieu qui est la température la plus faible, jusqu'à ce que leurs températures soient égales. |

C13. Capacité thermique.
Un système de stocker de l'énergie sous forme d'énergie interne et restituée ensuite cette énergie. La capacité thermique $C$ traduit cette possibilité. Lors d'un transfert thermique l'énergie $Q$ il y a transfert d'énergie entre le système et l'extérieur qui se traduit par une variation de température delta t du système :
$Q \ = \ C.\Delta T$ où $C \ = \ m.c$
$Q$ : transfert thermique (J)
$C$ : capacité thermique (J.K-1)
$\Delta T $: variation de température (K)
$m$ : masse (kg).
$C$ : capacité thermique massique (J.kg-1.K-1)
C14. Flux thermique.
Un transfert thermique peut se faire plus ou moins rapidement. Pour évaluer vitesse de transfert, on détermine le flux thermique.
|
Définition : Le flux thermique $\Phi$ correspond au transfert thermique $Q$ qui s'écoule entre 2 milieux par unité de temps : $\Phi \ = \ \dfrac{Q}{\Delta t}$ $\Phi$ : en Watt (W) Q : transfert thermique (J) $\Delta t $ : durée (s) |
C15. Résistance thermique.
Quand on coupe le chauffage d'une habitation en hiver, sa température va baisser d'autant plus rapidement que la différence de température entre l'intérieur et l'extérieur est importante. Cette baisse sera ralentie si les murs sont bien isolés.
|
Définition : La résistance thermique $R$ traduit l'opposition plus ou moins forte du système ou du matériau au flux thermique $\Phi$ . Plus elle est élevée, plus le flux thermique sera faible. Le flux thermique $\Phi$ est lié à la différence de température entre les 2 milieux pour lesquels le transfert thermique se fait et à la résistance thermique $R_{Th}$ par la relation : $\Phi \ = \ \dfrac{T_C-T_F}{R_{Th}}$ $T_c$ : température de la source chaude (K). $T_F$ : température de la source froide (K). $R_{TH}$ : résistance thermique (K.W-1) $\Phi$: flux thermique (W) |
Il existe une relation entre la résistance thermique d'un matériau et ses caractéristiques :
$R_{TH} = \ \dfrac{e}{\lambda S}$
$R_{TH}$ : résistance thermique (K.W-1)
$e$ : épaisseur du matériau (m)
$S$ : surface du matériau (m2)
$\lambda$ : conductivité thermique (W.m-1K-1)
C2. Premier principe de la thermodynamique.
C21. Energie interne.
Lors d'une étude énergétique, il faut d'bord définir le système que l'on étudie.
L'énergie interne de ce système est son énergie propre qui correspond à la somme de toutes les énergies existant dans ce système.
C21a. Au niveau microscopique.
Il serait très difficile d'appréhender toutes les énergies de toutes les particules du système. L'énergie interne ne peut donc être calculer directement. Par contre, étudier la variation $\Delta U$ de ce système est plus abordable.
L'énergie interne notée $U$, où sa variation $\Delta U$ s'exprime en joule (J)
C21b. Contributions microscopiques.
Les énergies présentes dans un système gazeux sont les énergies potentielles d'interaction et cinétiques entre les entités qui le constituent. Elles augmentent avec la température.
 |
 |
C22. Energie totale d'un système.
|
L'énergie totale d'un système est la somme de son énergie cinétique, de son énergie potentielle de pesanteur et de son énergie interne : $E_{totale} \ = \ E_c \ + \ E_{pp} \ + \ U$ NB : chaque énergie s'exprime en joules (J) |
|
Un système au repos à l'échelle macroscopique a une énergie macroscopique constante : $ E_c \ + \ E_{pp} \ =\ constante$ La variation totale de l'énergie est donc égale à la variation d'énergie interne. $\Delta E_{totale} \ = \ \Delta U$ |
C23. Premier principe de la thermodynamique.
|
Si un système clos au repos a son énergie a son énergie qui varie, c'est qu'il échange de l'énergie avec l'extérieur, soit sous forme de travail ($W$), soit sous forme de transfert thermique ($Q$) : $\Delta U \ = \ W \ + \ Q$ NB : chaque énergie s'exprime en joules (J) |
Exemple :
 |
$W_e$ correspond à l'énergie électriques fournie par le réseau électrique à la bouilloire et $Q$ est l'énergie fournie àà l'eau par la bouilloire. Pour la bouilloire : • $W_e$ > 0 elle reçoit de l'énergie électrique de la part du réseau électrique. • $Q < 0$ elle fournit de l'énergie calorifique à l'eau. ; |
C3. Deux lois thermiques.
C31. Loi de Stefan-Boltzmann.
Corps noir, déf : objet idéal qui absorbe toute l'énergie électromagnétique (lumière) qu'il reçoit. Cette absorption se traduit par une agitation thermique provoquant l'émission d'un rayonnement thermique, le rayonnement du corps noir.
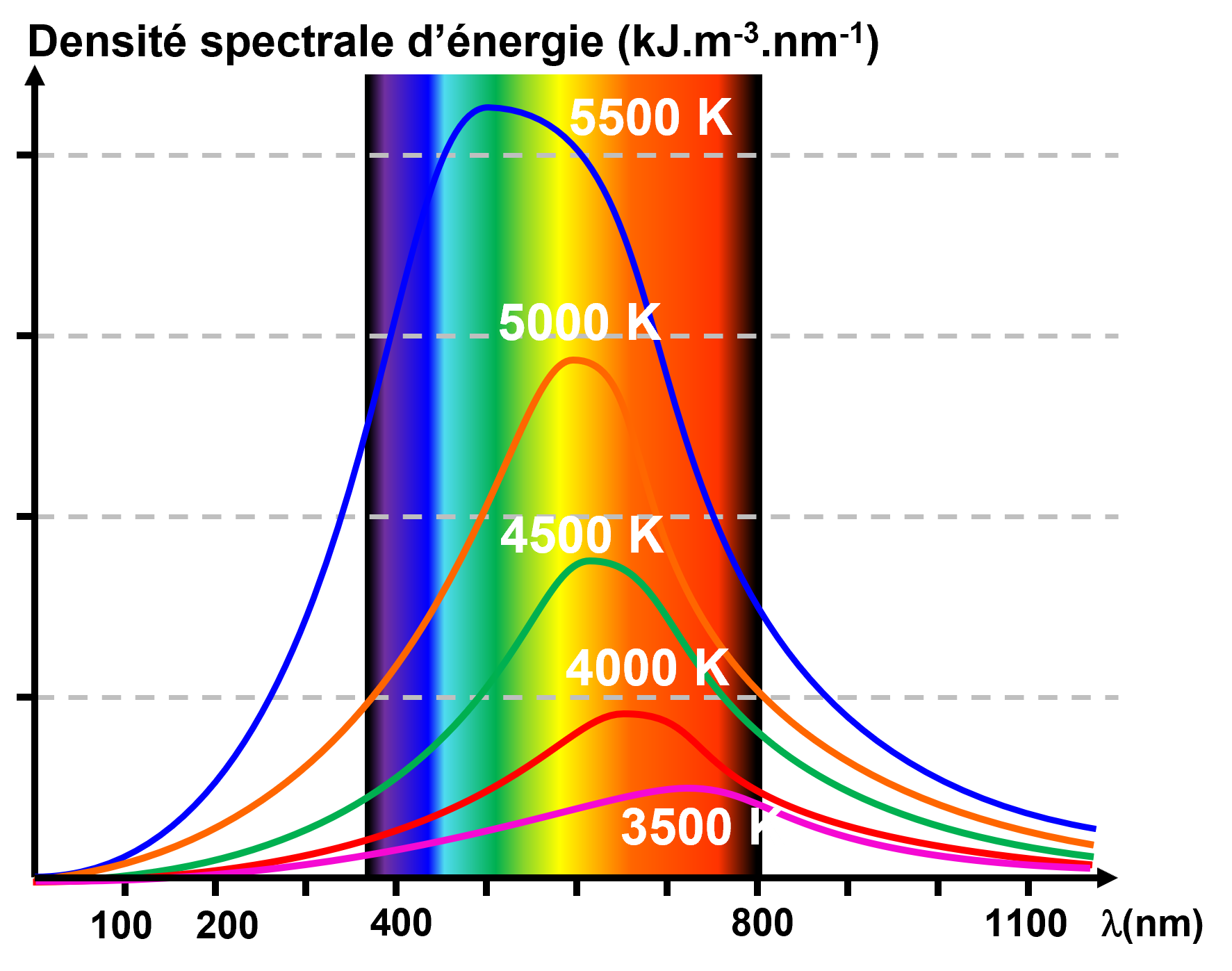 |
|
C32. Loi thermique de Newton.
Thermostat, déf : corps idéal dont la température reste constante.
|
Loi thermique de Newton : Le taux de variation de température d'un système incompressible et échangeant de l'énergie par un transfert thermique est proportionnel à la différence de température $T$ du corps et celle extérieure $T_{th}$ qui joue le rôle de thermostat : $\dfrac{dT}{dt} \ = \ - \ \gamma \times \left ( T - T_{Th} \right )$ |
Remarque :
La relation précédente est une équation différentielle du premier ordre à coefficients constants de solution :
$T(t) \ = \ A \ \times \ e^{ \ - \ \gamma \times t} \ + \ B$
Quand $t$ tend vers l'infini, $T$ tend vers $T_{Th}$ donc : $B \ = \ T_{Th}$
A $t \ = \ 0$, $T \ = \ T_0$ donc : $A \ = \ T_0 - T_{Th}$>
Donc : $T(t) \ = \ \left ( T_0 - T_{Th} \right ) \times \ e^{ \ - \ \gamma \times t} $
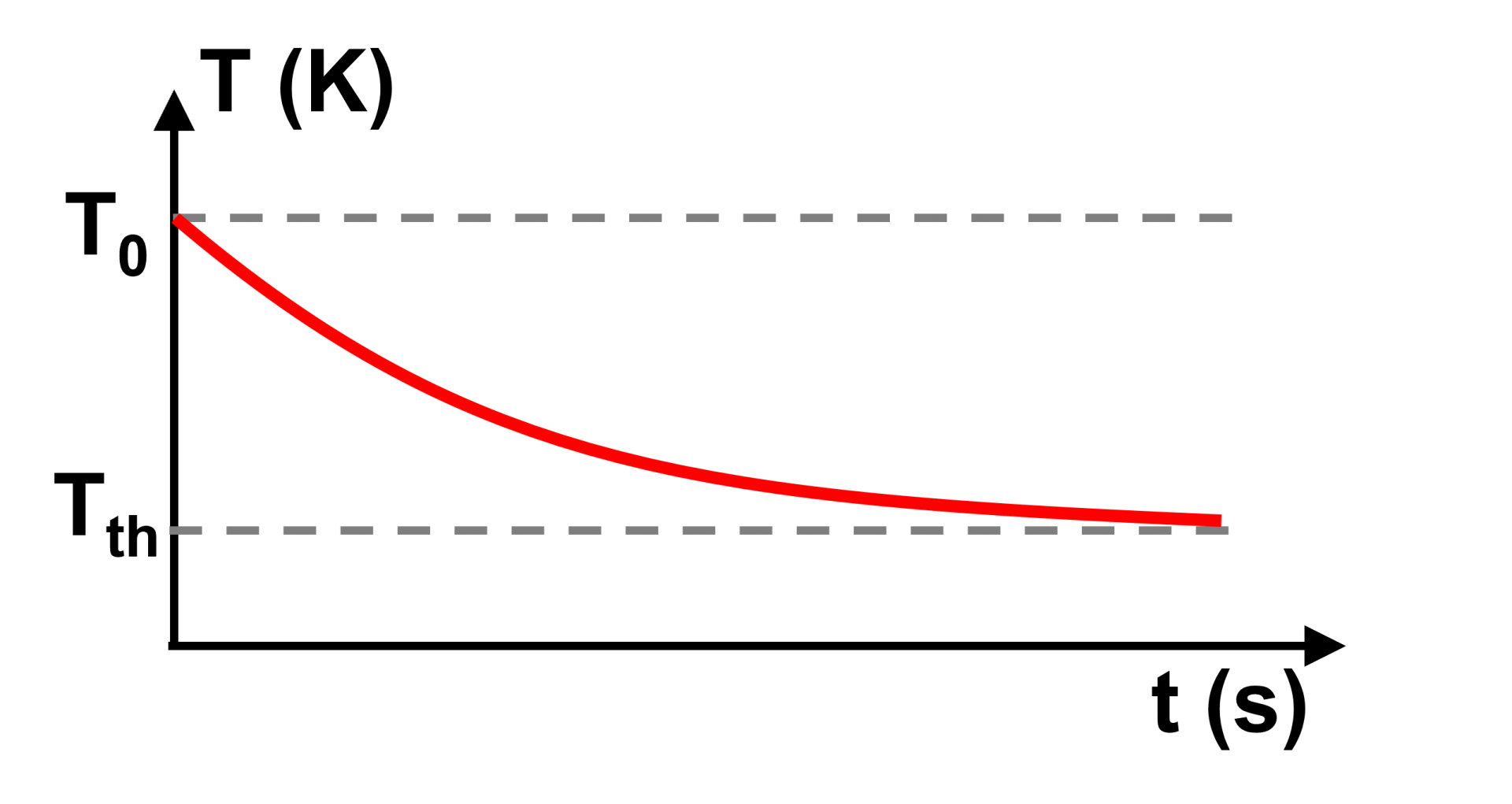
Evolution temporelle : fonction exponentielle décroissante.
Ajouter un commentaire









