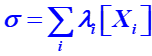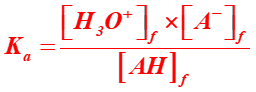Réaction chimique par échange de proton
ACTIVITES
A1 Mesures de pH de solutions aqueuses.
| Objectifs : |
- mesurer le pH de solutions d'acide chlorhydrique et éthanoïque (acétique). - Calculer le taux d'avancement final des réactions. - Dégager les notions d'acide fort et d'acide faible. - Expliquer l'origine du signe |
|
Définition : Le pH est lié à la concentration en ions oxonium [H3O+] (en mol/L) d'une solution aqueuse par la relation : pH = - log [H3O+] soit [H3O+] = 10 – pH
où la fonction x 10log(x) = x et log(10x) = x |
A11 Solutions d'acides.
A11a Solutions d'acide éthanoïque.
| Manipulation 1 : |
m11. Etalonner le pH-mètre m12. Dans un bécher, placer 100 mL d'eau. Ce bécher sera posé sur un agitateur magnétique. m13. Placer la sonde pH-métrique et lire la valeur indiquée (éviter le contact avec l'agitateur magnétique) m14. Ajouter quelques gouttes d'acide éthanoïque pur à l'aide d'une pipette pasteur, agiter, puis mesurer le pH. |
1. Que peut-on dire de l'effet de l'ajout d'acide dans l'eau distillée ?
2. Une réaction chimique a-t-elle lieu ? Pourquoi ?
3. Calculer les concentrations en ions oxonium dans les deux solutions.
4. Quels sont les réactifs et les produits ? Ecrire la réaction chimique.
A11b La réaction précédente est-elle totale ?
| Manipulation 2 : |
On dispose d'une solution S1 d'acide acétique (ou éthanoïque en nom systématique) de concentration c1 = 1,0.10-2 mol/L et de volume V1 = 100 mL. m21. Mesurer le pH de la solution S1.. |
1. Compléter le tableau d'avancement de la réaction précédente.
| Réaction : | |||||
| Avct | x = 0 | solvant | |||
| x | solvant | ||||
| x = xf | solvant | ||||
Info : xmax est l'avancement obtenu si la réaction était totale. xf est l'avancement obtenu en fin d'expérimentation.
2. Déterminer l'avancement xmax, avancement maximal.
3. Calculer la valeur de la concentration finale en ions oxonium [H3O+]f.
4. En déduire la valeur de xf.
5. Comparer xf et xmax. Conclure.
6. Calculer le taux d'avancement 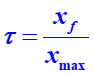 .
.
7. Proposer une explication de la notation 
A11c Solution aqueuse d'acide chlorhydrique.
|
Une solution d'acide chlorhydrique résulte de la dissolution du chlorure d'hydrogène gazeux dans l'eau, selon l'équation de réaction :
|
On dispose d'une solution S2 d'acide chlorhydrique de concentration en soluté apporté c2 = 1,0.10-2 mol/L et de volume V2 = 100 mL.
| Manipulation 3 : |
m31. Mesurer le pH de la solution. |
1. Compléter le tableau d'avancement de la réaction précédente.
| Réaction : | |||||
| Avct | x = 0 | solvant | |||
| x | solvant | ||||
| x = xf | solvant | ||||
Info : xmax est l'avancement obtenu si la réaction était totale. xf est l'avancement obtenu en fin d'expérimentation.
2. Déterminer l'avancement xmax, avancement maximal.
3. Calculer la valeur de la concentration finale en ions oxonium [H3O+]f.
4. En déduire la valeur de xf.
5. Comparer xf et xmax. Conclure.
6. Calculer le taux d'avancement 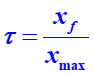 .
.
7. Proposer une explication de la notation 
A11d Acide chlorydrique et d'acide éthanoïque, quelle différence ?
1. Comparer les concentrations des deux solutions étudiées précédemment.
2. Comparer les valeurs de pH.
3. Comparer le caractère total des deux acides.
4. Comment repère-t-on le caractère total d'une réaction sur sa notation ?
A12 Notion d'équilibre : sens d'évolution d'un système chimique.
| Manipulation 4 : |
m41. Dans deux béchers, verser 20 mL de solution S1. m42. Dans le bécher 1, ajouter 0,5 g d'éthanoate de sodium CH3COONa(s). m43. Dans le bécher 2, ajouter 2 gouttes d'acide éthanoïque pur. m44. Agiter, puis mesurer les pH de chaque solution. |
1a. Comment évolue le pH dans le bécher 1 ? Comment évolue la concentration en ions H3O+ ?
1b. Dans quel sens évolue le système ?
2a. Comment évolue le pH dans le bécher 2 ? Comment évolue la concentration en ions H3O+ ?
2b. Dans quel sens évolue le système ?
3. Conclure quant au sens d'évolution chimique lors de l'ajout d'un réactif, ou d'un produit.
A13 Réaction Acide Fort / Base Forte.
| Problématique : | Caractériser qualitativement le comportement thermique d'une réaction acido-basique. |
|
L'acide chlorhydrique H3O +(aq) +Cl-(aq) et l'hydroxyde de sodium Na+(aq) + HO-(aq) réagissent selon l'équation :
|
| Manipulation 5 : |
m51. Observer les pictogrammes et prendre les mesures de sécurité nécessaires. m52. Dans un bécher de 250 mL, verser 100 mL d'acide chlorhydrique de concentration en soluté apporté 1, 0 mol.L-1. m53. Dans un second bécher de 250 mL, verser 100 mL de soude de concentration en soluté apporté 1, 0 mol.L-1. m54. Mesurer la température initiale θ i de ces deux solutions. m55. Verser avec précaution le contenu de l'un des béchers dans l'autre et agiter. m56. Mesurer la température finale θ f . m57. Effectuer la même manipulation avec des solutions diluées 10 fois. |
1. Comparer les valeurs finales atteintes par les deux mélanges réactionnels.
2. Le système chimique absorbe-t-il, ou libère-t-il de l'énergie ? Comment qualifier ce type de réaction ?
3. Quelle est l'influence de la concentration des solutions initiales sur l'évolution de la température ?
4. Calculer l'énergie thermique Eth libérée par la première réaction.
5. Calculer les quantités d'acide et de base utilisées dans cette réaction.
6. Calculer la valeur xmax de l'avancement de ces deux réactions.
7. Quelle serait l'énergie libérée si l'avancement était de 1 mole ?
8. La valeur de référence est tabulée à Eth = 57 kJ.mol-1. Evaluer l'incertitude relative relative à la valeur déterminée par l'expérience.
NB : On considère que la perte d'énergie du bécher vers le milieu extérieur est négligeable.
On rappelle que la variation d'énergie d'un système de la température θ i vers la température θ f est
donnée par la relation : Q = m.c(θ f – θ i ).
Le mélange est considéré comme de l'eau de capacité thermique c = 4,18 J.g-1.K-1.
A2 Déterminer le pKa par conductimétrie.
A21 Réaction de l'acide avec l'eau, concentrations des différentes espèces.
|
Un acide carboxylique RCOOH introduit dans l'eau réagit avec celle-ci suivant l'équation :
La réaction estrapide et le mélange atteint un état d'équilibre. |
A21a. On considère de l'acide éthanoïque de concentration molaire c. Compléter le tableau ci-dessous.
| Réaction : | |||||
| Avct | x = 0 | n0 = c.V | solvant | ||
| x | solvant | ||||
| x = xf | solvant | ||||
A21b. Exprimer les concentrations des espèces en fonction de l'avancement x.
A21b. Exprimer les concentrations des espèces en fonction de c et [H3O+].
A21c. Exprimer le quotient 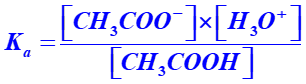 en fonction de c et [H3O+].
en fonction de c et [H3O+].
A22 Conductivité d'une solution et détermination de [H3O+] par conductimétrie.
|
|
A22a. Exprimer la conductivité σ de la solution d'acide éthanoïque décrite précédemment.
A22b. En déduire l'expression de [H3O+] en fonction de σ, ![]() et
et ![]() .
.
A23 Mesures.
| Matériel et produits : |
· Conductimètre. · Solutions de chlorure de potassium pour l'étalonnage. · Fioles jaugées, pipettes, propipettes, béchers. · Solution mère d'acide éthanoïque (acétique) et d'acide méthanoïque (formique) à c0 = 1,00.10-1 mol.L-1. |
|
Manipulation 6: |
Etalonnage du conductimètre: m61. Régler le bouton de température sur celle des solutions utilisées (celle de la salle). m62. Placer la sonde conductimétrique dans la solution étalon et ajuster le bouton de réglage pour que la conductivité s de la solution soit celle indiquée sur le flacon (pour 25°C). Préparation des différentes solutions : m63. Proposer un protocole pour obtenir, à partir des solutions mères, des solutions aux concentrations c1 = 1,00.10-2 mol.L-1 et c2 = 1,00.10-3 mol.L-1. m64. Compléter les tableaux ci-dessous. |
 |
Le conductimètre indique des mS.cm-1 |
Pour l'acide acétique :
| Concentration (mol/L) | c0 = 1,00.10-1 | c1 = 1,00.10-2 | c2 = 1,00.10-3 |
| s en mS.m-1 | |||
| [H3O+] = …………….………. = …………….. en ……. | |||
| [H3O+] en mol/L =………………… | |||
| KA = …………………………. | |||
| pKA = -log KA |
Pour l'acide formique :
| Concentration (mol/L) | c0 = 1,00.10-1 | c1 = 1,00.10-2 | c2 = 1,00.10-3 |
| s en mS.m-1 | |||
| [H3O+] = …………….………. = …………….. en ……. | |||
| [H3O+] en mol/L =………………… | |||
| KA = …………………………. | |||
| pKA = -log KA |
A23a. Que peut-on dire du quotient KA (ou du KA) d'un acide lorsqu'on modifie sa concentration ?
A23b. Des deux acides, quel est le plus faible ? Justifier.
A23c. Comparer avec les valeurs théoriques de pKA : pKa(CH3COOH/CH3COO-) = 4,75 et pKa(HCOOH/HCOO-) = 3,75
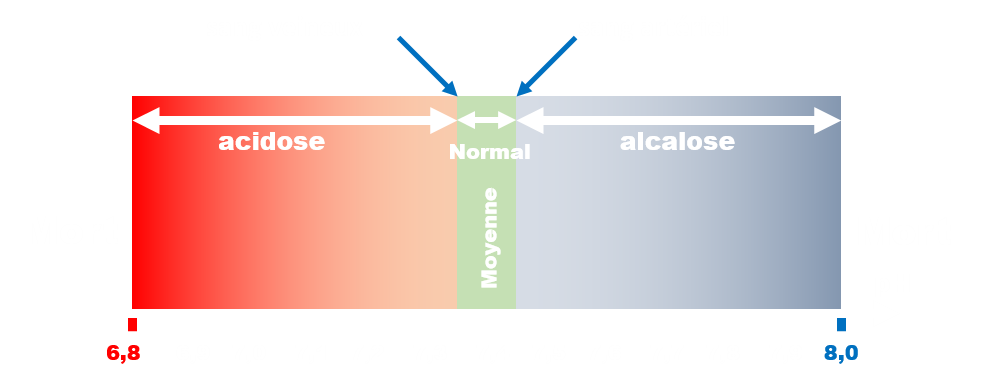
A3 Intérêt du contrôle du pH dans un milieu biologique.
Les liquides biologiques sont des solutions aqueuses dans lesquelles se produisent de nombreuses réactions chimiques. La plupart d'entre elles nécessite, entre autre, que le pH soit maintenu constant.
Comment le pH d'un milieu biologique est-il stabilisé ? Quelles peuvent être les conséquences d'une variation trop importante de sa valeur ?
|
· Des ions oxonium [H3O+] dans l'organisme.
· pH des liquides biologiques.
|
|
· Le tampon phosphate.
|
|
· Le tampon bicarbonate.
|
|
· Les calculs urinaires.
|
|
· De l'importance du pH dans la formation des calculs urinaires.
|
A31. Quelle est la différence entre métabolisme et catabolisme ? pourquoi parle-t-on de métabolisme du glucose ?
A32. Rechercher les noms des différents liquides (sucs) produits au cours de la digestion ainsi que leur caractère acide ou basique.
A33. Qu'est-ce qu'une «solution tampon» ?
A34. Pourquoi les liquides des organismes vivants doivent-ils contenir des systèmes chimiques «tampons» ?
A35. La dissolution de dioxyde de carbone dans une solution aqueuse provoque une acidification de la solution. Justifier alors que le pH du sang veineux est inférieur à celui du sang artériel.
A36a. Pour un pH sanguin égal à 7,4 à 37°C, calculer la valeur du rapport 
A36b. Quelle espèce chimique du « tampon bicarbonate» prédomine alors dans le sang ?
A37. Pour le « tampon phosphate», le pKA du couple à 37°C est égal à 6,9.
A76a. Par analogie avec l'expression du pH donnée dans le texte pour le « tampon bicarbonate», déterminer l'expression du pH contenant les ions et à 37°C.
A37b. Dans un liquide intracellulaire, on suppose que les concentrations initiales en ions dihydrogénophosphates ![]() et en ions hydrogénophosphates
et en ions hydrogénophosphates ![]() sont telles que :
sont telles que :
[H2PO4-]i = [HPO42-]i = 80 mmol/L
Quel est le pH initial de la solution ?
A37c. Une réaction enzymatique fournit 20 mmol/L d'ions oxonium H3O+ . Ces ions réagissent totalement avec l'ion hydrogénophosphate HPO42- . Calculer le pH final après la réaction. Justifier alors l'appellation « tampon phosphate».
A38a. Quelle espèce ionique est majoritairement présente dans l'eau de Vichy ?
A38b. L'équation de la réaction entre l'acide urique et l'ion hydrogénocarbonate est :
![]()
Comment la consommation d'eau de Vichy peut-elle aider à la dissolution d'un calcul d'acide urique ?
COURS
C1 Définition du pH.
C11 pH et acidité.
|
Définition : |
|
L'ion H3O+ provient de la protonation des molécules d'eau. Les protons H+ ne peuvent rester seuls dans un milieu aqueux. Ils se lient par liaison hydrogène aux doublets non liants de l'oxygène de la molécule d'eau.
A 25°C, le pH d'une solution aqueuse est compris entre 0 et 14.
Plus une solution contient d'ions H3O+, plus son pH est faible et plus elle est acide.
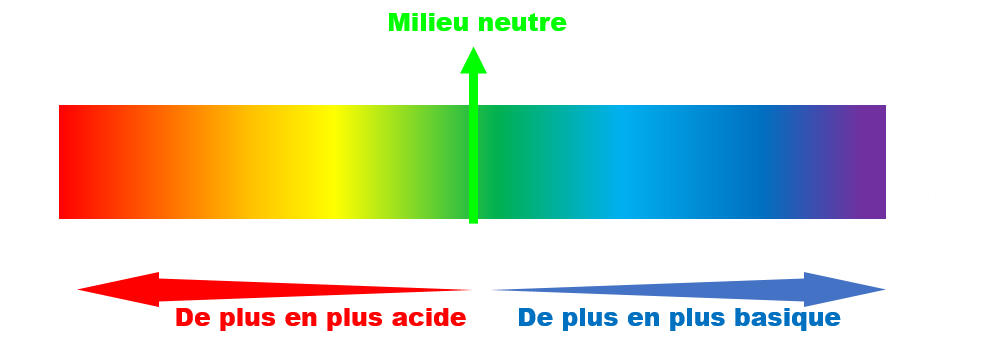
C12 Mesure du pH.
|
Le papier pH permet de déterminer approximativement le pH d'une solution. Il contient des indicateurs colorés de pH dont les couleurs varient en fonction du pH. |
Le pH peut être déterminer plus précisément à l'aide d'un pH-mètre étalonné avec des solutions de pH connus. · Pour mesurer le pH d'une solution acide, on l'étalonne avec des solutions tampons à pH = 7 et pH = 4. · Pour mesurer le pH d'une solution basique, on l'étalonne avec des solutions tampons à pH = 7 et pH = 9. |
C2 Equilibre acido-basique.
C21 Produit ionique de l'eau.
 |
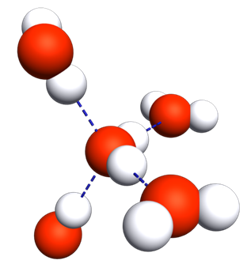 |
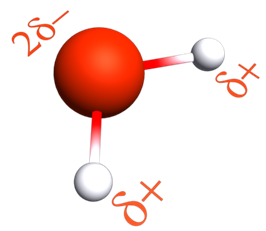
La molécule d'eau est polarisée à cause de l'importante différence d'électronégativité entre les atomes d'hydrogène et de l'atome d'oxygène.
Il se forme donc des liaisons hydrogène entre l'atome d'oxygèned'une molécule avec l'atome d'hydrogène d'une autre molécule.
Cet équilibre se traduit par :
![]()
On parle d'autoprotolyse de l'eau.
On appelle produit ionique de l'eau, noté Ke la grandeur sans dimension :
Ke = [H3O+]x[HO-] à 25°C
C22 Acides et bases : définitions.
 |
En 1923, le chimiste danois Joannes Brönsted (1879 – 1947) propose une interprétation des réactions qui se produisent entre les acides et les base, ou réactions acido-basiques :
|
C23 Couple Acide/Base.
|
Deux entités forment un couple acide/base s'il est possible de transformer l'une en l'autre par perte ou gain d'un seul ion hydrogène. Les deux entités sont dites conjuguées. |
De manière générique, on symbolise un acide par la notation AH, qui va céder un proton H+ et former sa base conjuguée notée A-.
Ces deux espèces forment le couple acide/base noté AH /A-.
La demi-équation reliant l'acide et la base d'un même couple est une demi-équation acido-basique :
![]()
NB1 : Dans cette notation, la double flèche indique qu'elle se produit dans les deux sens, simultanément, et que
par conséquent, elle n'est pas totale.
NB2 : Certaines espèces peuvent se comporter en acide ou en base. Ce sont des ampholytes qui appartiennent
donc à plusieurs couples acide/base.
C24 Réaction acido-basique.
|
Deux couples acide/base interviennent au cours d'une réaction acido-basique. L'ion H+ cédé par un acide AH est capté par la base B d'un autre couple. Les espèces conjuguées sont formées :
|
C25 Notion d'équilibre chimique.
|
Un système chimique, siège d'une réaction limitée atteint un équilibre chimique lorsque les concentrations des espèces présentes n'évoluent plus. Cet état d'équilibre est dynamique : la réaction ne cesse pas, mais deux transformations inverses ont lieu simultanément. |
NB : Dans ce cas, le réactif limitant ne disparaît pas totalement à l'état final.
L'avancement maximal xmax n'est pas atteint.
L'avancement final xf observé est forcément inférieur à l'avancement maximal.
C26 Acides forts, bases fortes.
Ce sont des entités dont la réaction avec l'eau est totale.
|
Acide Fort
Dans ce cas, pH = -log c |
Base Forte
Dans ce cas, pH = - log(Ke/c) |
||||||||||||||||||||||||||||||||||||||||
C27 Réaction Acide Fort/Base Forte.
|
· Les acides et les bases sont corrosifs. · Le contact avec la peau ou l'œil peut provoquer de graves brûlures. · D'autre part, leur réaction avec l'eau entraine une élévation de la température. · Si de l'eau est versée dans un acide fort ou une base forte, il y a risque de projection. · Le port des lunettes, de la blouse et des gants est obligatoire lors de leur manipulation. |
 |
Réaction :
Dans une réaction d'acide fort, ce dernier réagit totalement pour donner des ions H3O+.
Dans une réaction de base forte, cette dernière réagit totalement pour donner des ions HO- .
La réaction entre un acide fort et une base forte est quasi-totale et se rapporte donc à :
![]()
C28 Acides faibles.
Un acide AH est dit faible si sa réaction avec l'eau n'est pas totale et conduit à un équilibre.
| Réaction : | 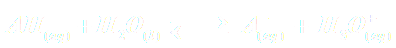 |
||||
Avct |
x = 0 | n0 | solvant | 0 | 0 |
| x | n0 -x | solvant | x | x | |
| x = xf | n0 -xf | solvant | xf | xf | |
NB : La réaction n'étant pas totale, on a xf < n0 et donc : 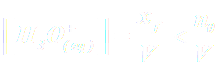 soit : pH > -log c.
soit : pH > -log c.
C29 Base faibles.
Une base B est dite faible si sa réaction avec l'eau n'est pas totale et conduit à un équilibre.
| Réaction : | 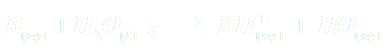 |
||||
Avct |
x = 0 | n0 | solvant | 0 | 0 |
| x | n0 -x | solvant | x | x | |
| x = xf | n0 -xf | solvant | xf | xf | |
NB : La réaction n'étant pas totale, on a xf < n0 et donc : 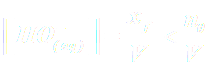
soit :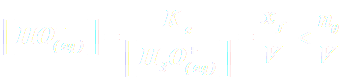
soit : 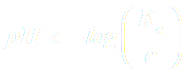 .
.
C3 Comprendre : pH et équilibre chimique du vivant.
C31 Définition du pKa.
• L'état d'équilibre où les concentrations de l'acide et de la base conjuguée n'évoluent plus se traduit par une constante, propre à chaque couple acide/base qui ne dépend plus que de la température.
|
Un couple ACIDE FAIBLE / BASE FAIBLE AH / A- est caractérisé par sa constante d'acidité Ka, grandeur sans dimension définie par :
où [H3O+]f , [A-]f et [AH]f sont les concentrations à l'état final. On associe à cette grandeur, le pKa défini par : pKa = -log Ka. |
• Plus le pKa d'un couple est grand (ou plus la constante d'acidité Ka est faible), moins l'acide se dissocie dans l'eau (plus il est faible).
• En général, une modification de la concentration d'une espèce au sein d'un système chimique à l'équilibre provoque une évolution de ce système qui tend à s'opposer à cette modification.
• Quelques valeurs de pKa.( Les pKa varient de 0 à 14).
| Couple Acide/Base | pKa |
| H3O+ / H2O | 0,0 |
| HF / F- | 3,2 |
| HCOOH / HCOO- | 3,8 |
| CH3COOH / CH3COO- | 4,8 |
| CO2,H2O / HCO3- | 6,4 |
| NH4+ / NH3 | 9,2 |
| HCO3- / CO32- | 10,3 |
| H2O / HO- | 14,0 |
• Diagramme de prédominance :
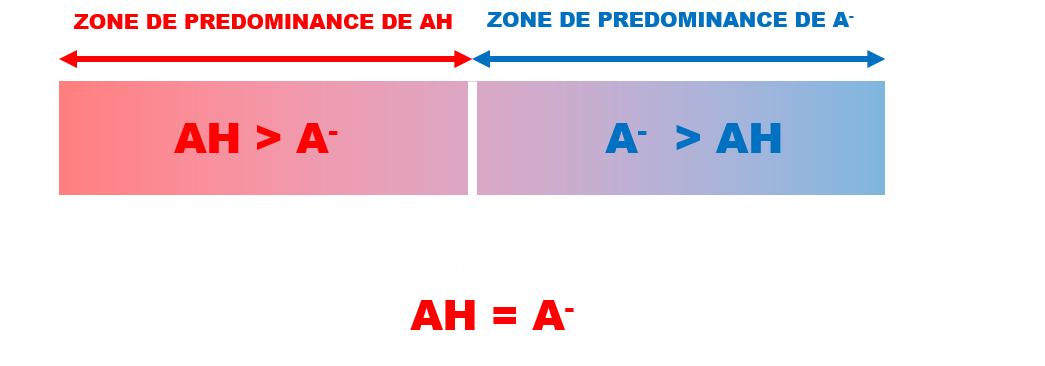
C32 pH et milieux biologiques.
C32a Les acides α-aminés.
|
Ce sont des molécules organiques qui comportent un groupe carboxyle et un groupe amine sur le même carbone (dit alpha). Ils jouent un rôle important dans le vivant, car ils s'assemblent pour former des macromolécules : les protéines.
Leur groupe carboxyle leur donne la propriété d'un acide, et le groupe amine, celui d'une base. De ce fait, ils existent sous trois formes : AH2+ , AH+ - et A-. |
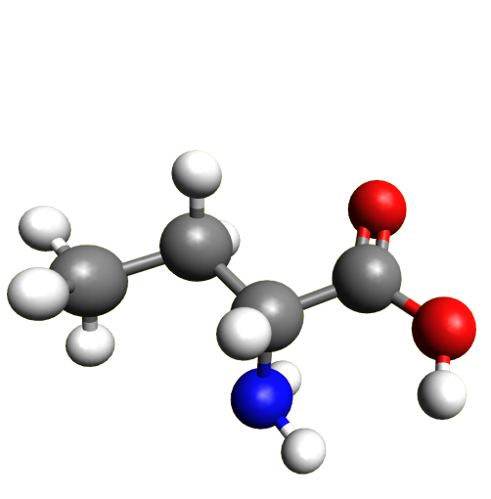 |
Ces molécules constituent deux couples acide/base AH2+ / AH+ - de pKa1 et AH+ - / A- de pKa2.
Le diagramme de prédominance comporte alors trois zones :
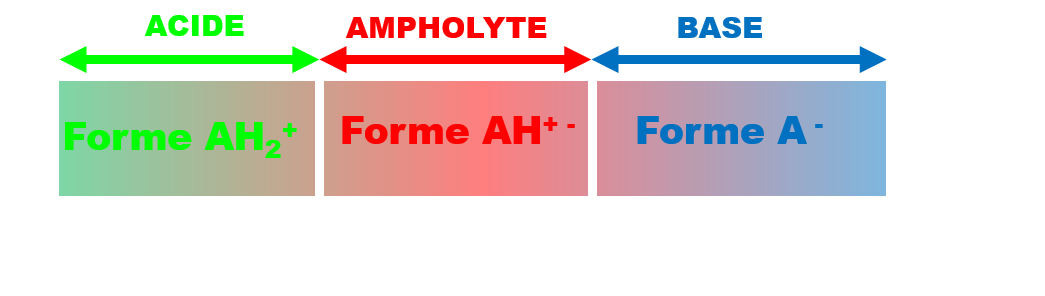
C32b Effet tampon.
Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute des quantités modérées d'acide et / ou de base, ou par dilution modérée.
Dans les processus biochimiques des organismes vivants sont extrêmement sensibles aux variations de pH : l'activité enzymatique dépend du pH et les cellules peuvent subir des dommages irréversibles lorsqu'il sort de certaines limites. Le Ph des milieux biologiques comme le sang est régulé par un ensemble de solutions tampons qui minimisent les variations de pH.
Ajouter un commentaire