Modèle du Gaz Parfait
ACTIVITES
A1. Décrire le comportement d'un gaz.
Les valeurs de la masse volumique, de la température thermodynamique et de la pression d’un gaz sont liées aux propriétés de ces constituants microscopiques.
Quels sont ces liens ?
|
|
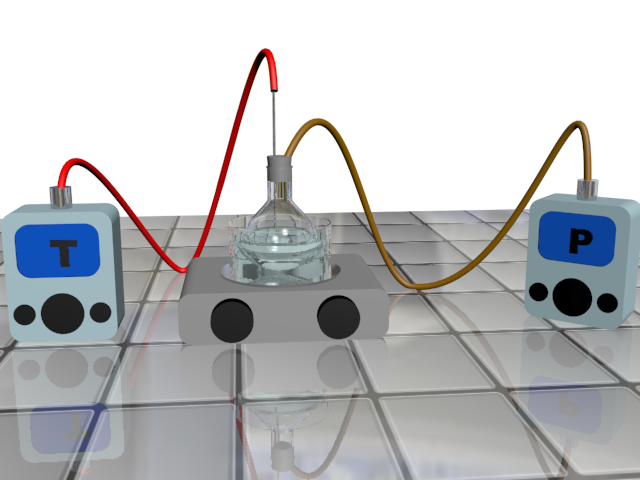
Doc2 : Modèle microscopique du gaz parfait. Un gaz, supposé parfait, est enfermé dans un récipient. Une quantité n de gaz occupe un volume V à la température thermodynamique T. Ces valeurs peuvent être modifiées. On observe le comportement des constituants du gaz et l'effet sur la pression P.
|
|
|
S’approprier
Faire le lien entre le comportement des constituants microscopiques et :
• La pression P mesurée.
• La température T mesurée.
• Le volume V mesuré.
• La masse volumique $\rho$.
Analyser-raisonner
Donner en justifiant la relation qui permet de modèliser, pour un gaz parfait, le lien entre les grandeurs macroscopiques mesurées :
| $a. PV = nRT $ | $b. PV = \dfrac{RT}{n} $ | $c. PT = nRV $ | $d. PT = \dfrac{nR}{T} $ |
(R et n désignent respectivement une constante et la quantité de matière présente dans l'échantillon)
A2. L'équation d'état du gaz parfait.
Le comportement du gaz parfait, représentation simplifiée des gaz réels, est modélisé par l'équation d'état du gaz parfait.
Comment valider ce modèle expérimental ?
|
|
Doc2 : L'équation d'état du gaz parfait. On appelle "gaz parfait" un gaz pour lequel la relation suivante est vérifiée : $PV = nRT$ P : pression en Pascal (Pa) n : quantité de matière en mole (mol) V : Volume en mètre cube (m3) R : constante du gaz parfait (8,31 J.K-1.mol-1) T : température thermodynamique en Kelvin (K) |
|
Doc3 : La température thermodynamique. $T=\theta + 273,15$ T : température thermodynamique en Kelvin (K). $\theta$ : température en degré Celsius (°C) La température thermodynamique rend compte du degré d'agitation microscopique des particules d'un système. Quand il n'y a pas d'agitation, T = 0 K : c'est le zéro absolu. |
REALISER
• Mettre en œuvre le protocole du doc1.
• À l’aide d’un tableur, montrer graphiquement que l’évolution P = f(θ) d’un volume d’air constant suit avec une bonne approximation celle d’une fonction affine.
• Déterminer par extrapolation vers les températures basses (graphiquement ou par le calcul) la valeur de l’abscisse θ à l’origine. À l’échelle microscopique, quelle est la signification de cette valeur ?
• Montrer graphiquement que l’évolution de la pression P (en Pa) du volume d’air est proportionnelle à la température thermodynamique T (en K).
• Faire correspondre la valeur et l’unité du coefficient directeur de la courbe P = f(T) aux termes de l’équation d’état du gaz parfait.
Valider
• Dans les conditions de l’expérience, l’air peut-il être assimilé à un gaz parfait ? Justifier la réponse.
• La valeur de référence du zéro absolu valide-t-elle l’étude réalisée ?
A3. Estimer les limites du modèle du gaz parfait.
Le gaz parfait n'existe pas, mais dans certaines conditions de pression et de température, les résultats obtenus à partir de ce modèle s'appliquent avec une bonne approximation aux gaz réels.
Pour quelles valeurs de la pression peut-on appliquer ce modèle ?
|
|
|
Doc 3 : Préparation du dioxyde de carbone.
|
|
Doc 4 : Matériel. Un thermomètre, une seringue et son tuyau, un manomètre, un erlenmeyer et son bouchon percé, un morceau de craie, une solution d’acide chlorhydrique concentré, un ordinateur muni d’un tableur-grapheur, une blouse, des gants et lunettes de protection. Données : Vm = 24,1 L.mol-1 à 20°C et 1 atm |
Réaliser
• Mettre en œuvre une expérience permettant de relever, à température constante, différents couples de valeurs $\left ( P_{GR},V \right )$ : pression du dioxyde de carbone-volume total occupé dans une seringue.
• Faire afficher le graphe $P_{GR}= f(V) $. Modéliser éventuellement la courbe d’évolution obtenue par une fonction inverse : $P_{GR} = f \left ( \dfrac {a}{V} \right ) $
• Calculer, pour chacun des volumes précédents, la pression PGP du gaz si on appliquait le modèle du gaz parfait.
Superposer PGP = f(V) $P= f (V) $ au graphique précédent.
• Comparer l’écart de pression entre le gaz réel et le modèle du gaz parfait pour les différentes pressions.
Valider
• Pour quelles valeurs de la pression du gaz ce modèle peut-il être appliqué ?
• Proposer une interprétation à l’échelle microscopique.
Exercices : 13, 14, 15, 17, 18, 20, 21, 22, 24, 26 et 27 pages 385 à 388.
COURS
C1. Description d'un gaz.
C11. Les grandeurs macroscopiques.
À l'échelle macroscopique, l'état d'un gaz peut être décrit au moyen de trois grandeurs mesurables : la pression P, la température T et la masse volumique $\rho$. Ces grandeurs sont indépendantes c'est à dire que la variation de la valeur de l'une d'entre elle modifie la valeur d'au moins une des deux autres.
| Grandeur | Symbole |
Unité USI (autres) |
Mesure |
| Température | T |
K (°C, °F) |
Thermomètre |
| Pression | P |
Pa (bar, atm) |
Manomètre |
| Masse volumique | $\rho$ | kg.m-3 | Calcul par mesure de la masse et détermination du volume |
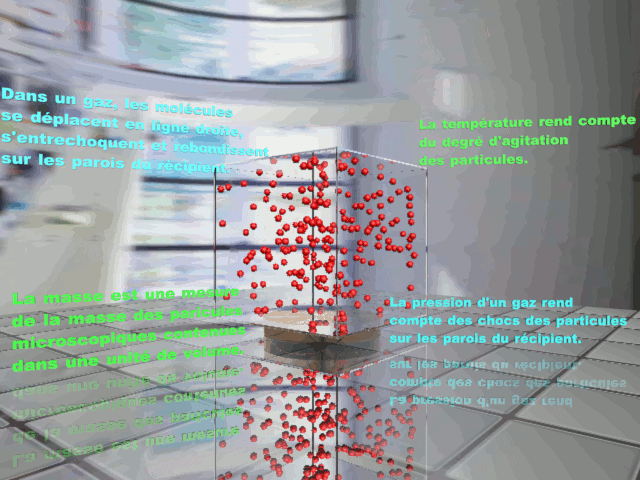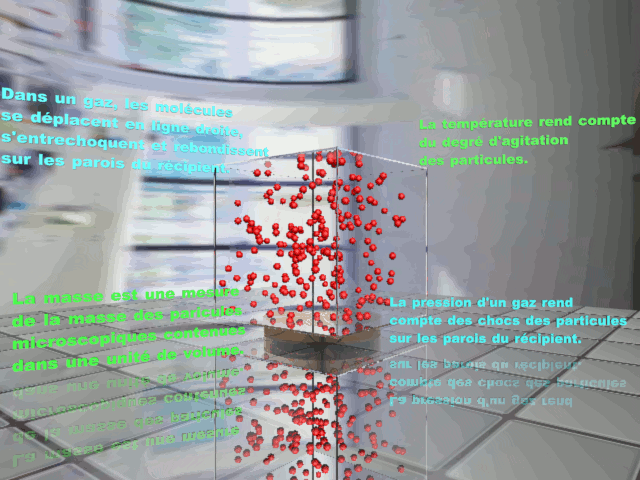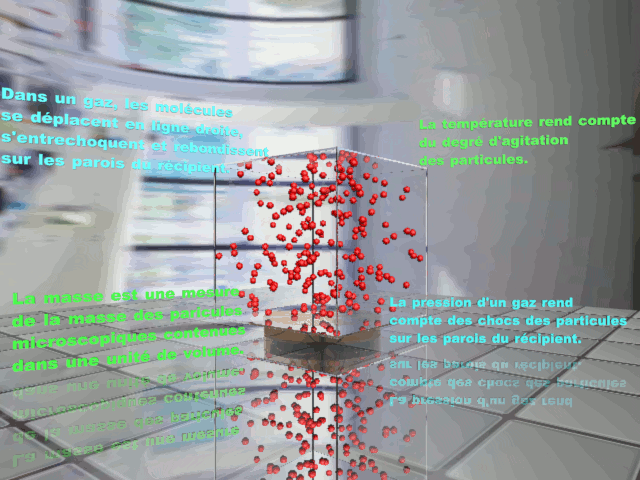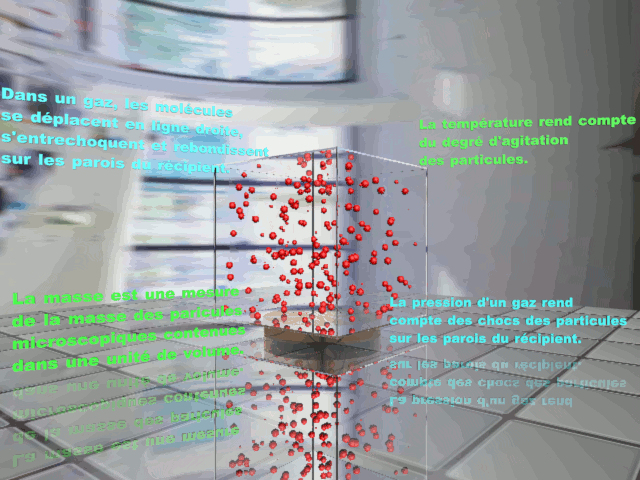
C12. Interprétation microscopique.
|
À l'échelle microscopique, un gaz est décrit par un ensemble de particules (des atomes ou des molécules) distantes les unes des autres et en mouvement incessant. Les valeurs prises par les grandeurs macroscopiques mesurées sont liées aux propriétés des constituants microscopiques du gaz. |
 |

C13. L'état d'équilibre du gaz.
|
À l'échelle microscopique, l'état gazeux se caractérise par un mouvement désordonné des entités constituant le gaz, libres de se déplacer dans tout le volume offert au gaz. Une espèce à l'état gazeux est caractérisée par les grandeurs ci-dessus. Cette grandeur macroscopique correspond à la moyenne d'un très grand nombre des événements microscopiques. Lorsque les grandeurs macroscopiques décrivant un gaz sont constantes dans le temps et identique en tout point du gaz, celui-ci est dit en équilibre thermodynamique. |
 |
C14. La température thermodynamique.
Exprimée en degrés Celsius, la valeur d'une température ne rend pas compte du degré d'agitation microscopique des particules d'un système.
L'échelle de mesure adaptée utilise le kelvin (K)comme unité.
La température thermodynamique (aussi nommée température absolue) traduit le degré d'agitation des molécules d'un système.
Notée T, et exprimée en kelvin (K), elle est liée à la température $\theta$ (°C) de l'échelle Celsius par la relation suivante :
$T = \theta + 273,15 $
C2. Le Gaz Parfait.
C21. Hypothèses de modélisation.
Le gaz parfait ta modèle formalisé au 19ème siècle il est fondé sur l'observation expérimentale selon laquelle tous les gaz tendent vers un comportement unique à pression suffisamment basse, quels que soient les entités constituant le gaz.
|
Les entités qui composent un gaz parfait :
|
C22. L'équation d'état du gaz parfait.
|
P : pression en Pascal (Pa) n : quantité de matière en mole (mol) V : Volume en mètre cube (m3) R : constante du gaz parfait (8,31 J.K-1.mol-1) T : température thermodynamique en Kelvin (K) |
NB : on retrouve la loi de Boyle-Mariotte étudiée précédemment selon laquelle, à une température fixée :
$PV = cste$
C23. Limites du modèle du gaz parfait.
Le modèle du gaz parfait permet de décrire le comportement d'un gaz par le calcul de grandeurs caractéristiques et la prévision où l'interprétation de leurs éventuelles variations.
Le modèle du gaz parfait s'applique aux gaz de pression inférieure à 1 MPa environ.
Il ne s'applique plus quand la température se rapproche de 0 K.
• Le modèle du gaz parfait donc une excellente approximation du comportement de tous les gaz à pression et température modérées.
• Il est ainsi possible de calculer une quantité de matière de gaz à partir du volume de gaz mesuré dans des conditions usuelles de température et de pression, à 20 degrés Celsius et un bar par exemple.
• Il n'est par contre pas pertinent d'utiliser ce modèle pour décrire un gaz comme le méthane piégé dans des hydrates de gaz à des profondeurs ou à la pression dépasse 3 MPa.
Ajouter un commentaire