Transformations Physiques et Energie
ACTIVITES
A1. Modéliser un changement d'état.
Dans la cuisine, ce sont des changements d'état qui permettent la cuisson et la conservation des aliments.
Quels sont les différents changements d'état rencontrés en cuisine ?
|
Doc1 : Le popcorn.
|
|
Doc2 : Un verre d'eau glacée.
|
|
Doc3 : Aliment lyophilisé.
|
|
Doc 4 : Repas à la montagne.
|
A11. Analyser.
$\bullet$ Nommer les différents changements d'état apparaissant dans les doc 1 et 2.
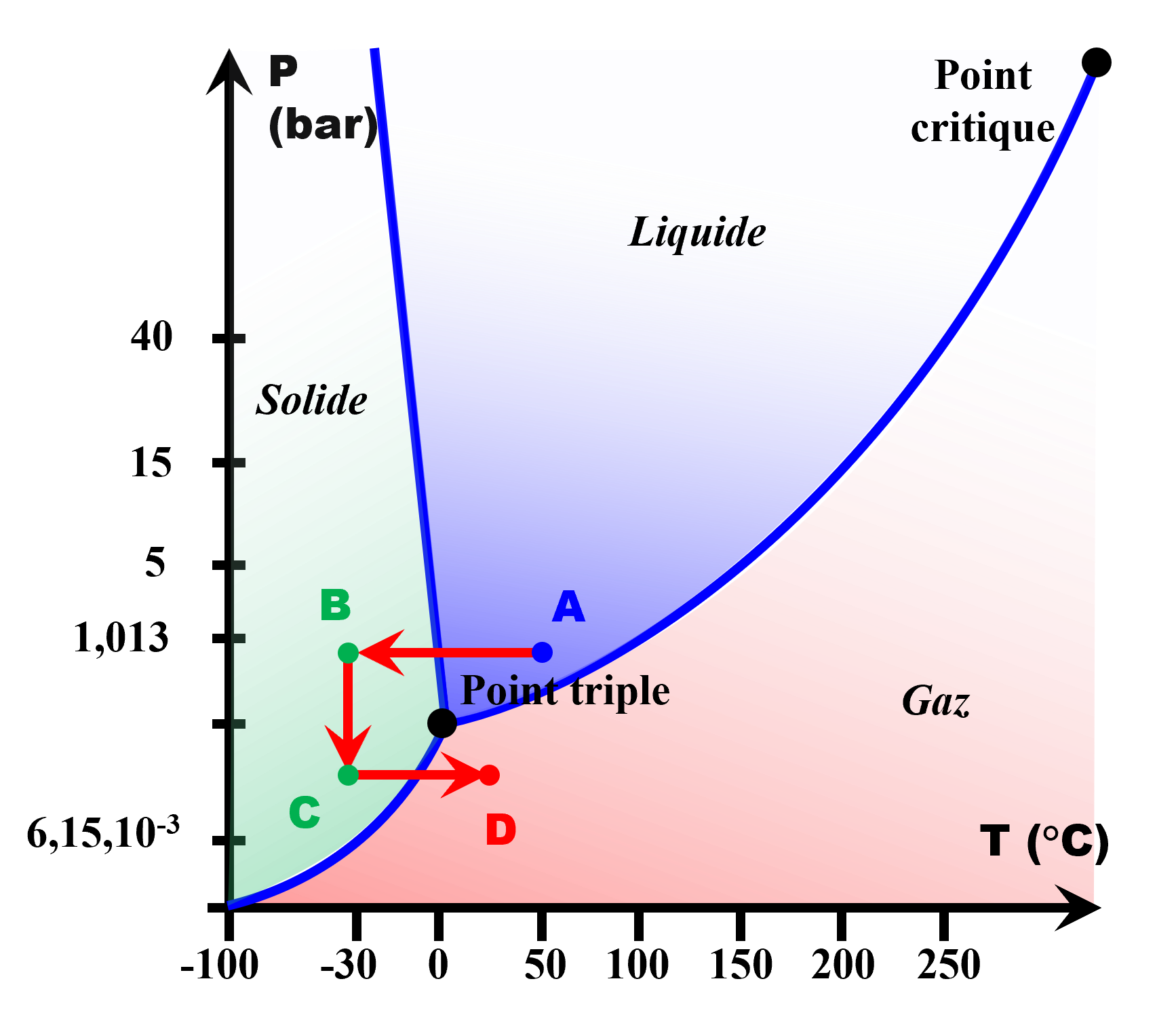
$\bullet$ Indiquer les transformations physiques de l'eau dans le processus de lyophilisation, entre les points A, B et C (doc3).
$\bullet$ Donner le nom d'un changement d'état qui n'apparaît pas dans les documents. Donner un exemple de la vie courante.
A12. Conclusion.
$\bullet$ Compléter le schéma ci-dessous en indiquant les types de changement d'état.
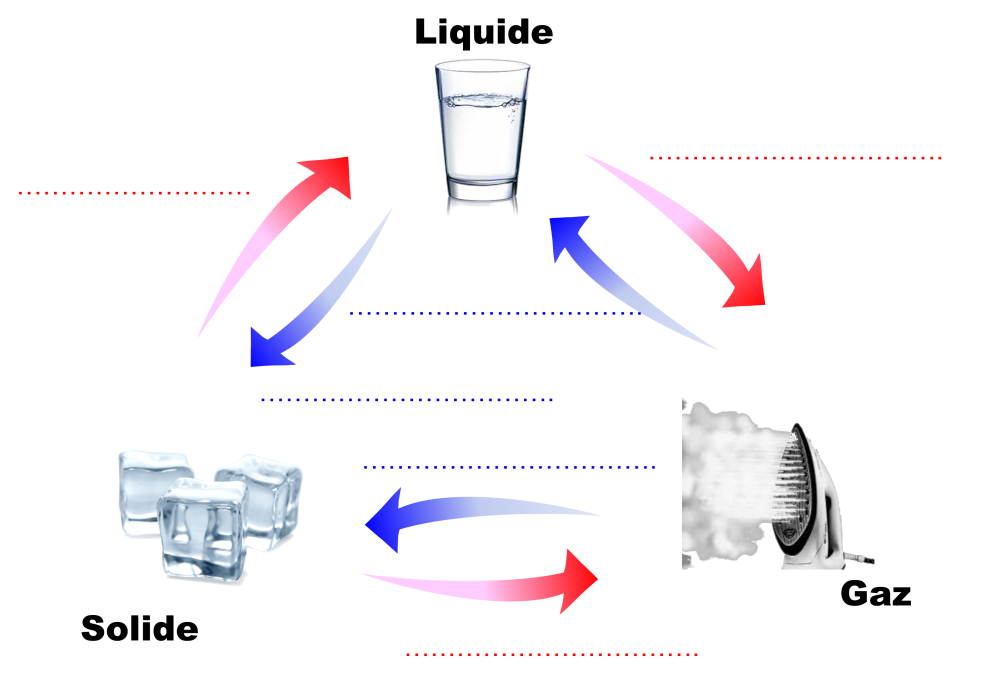
$\bullet$ Préciser la variation de température lors de chaque changement d'état.
$\bullet$ Décrire la situation décrite dans le doc4. et trouver une raison au phénomène observé.
A2. Changement d'état et énergie.
Un réfrigérateur permet de conserver les aliments plus longtemps en abaissant leur température.
Comment expliquer la basse température régnant à l'intérieur d'un réfrigérateur ?
|
|
|
Doc 4 : Etats du fluide frigorigène.
|
A21. Analyse.
$\bullet$ Quel changement d'état du fluide frigorigène se produit dans l'évaporateur ?
$\bullet$ Préciser le sens du transfert thermique ayant lieu entre l'intérieur du réfrigérateur et le fluide dans l'évaporateur.
$\bullet$ Ce résultat est-il en accord avec le document 4 ?
$\bullet$ Quel changement d'état du fluide frigorigène se produit dans le condensateur ?
$\bullet$ Cette appellation couramment admise de condenseur est-elle correcte ? Proposer un autre nom au changement d'état concerné.
$\bullet$ Ce changement d'état est-il endothermique ou exothermique ?
A22. Synthèse.
$\bullet$ Expliquer comment les changements d'état du fluide frigorigène permettent d'abaisser la température à l'intérieur d'un réfrigérateur.
A3. Energie massique de l'eau.
La vaporisation de l'eau est une transformation endothermique.
Comment relier la masse d'eau vaporiser à la valeur du transfert thermique nécessaire à sa vaporisation ?
|
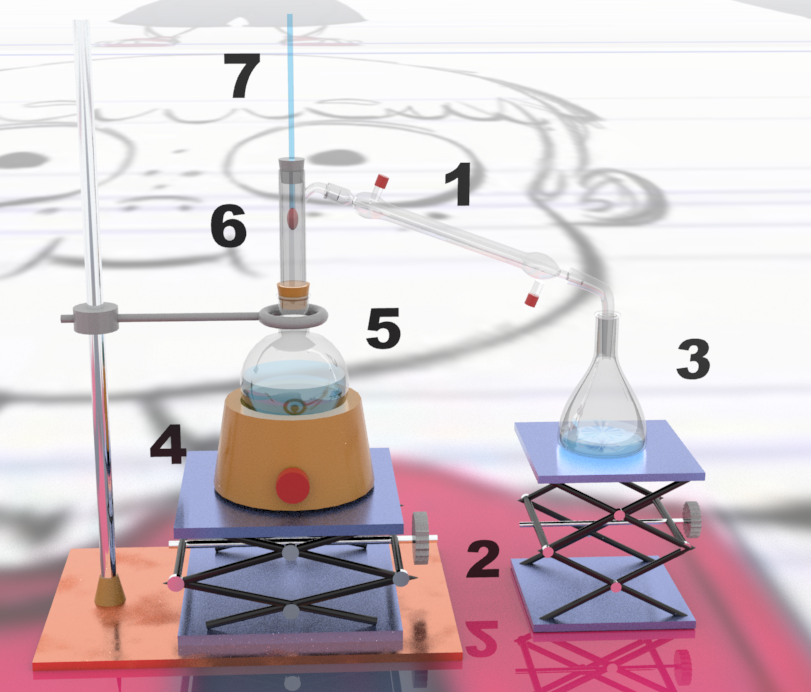
Doc 1: Montage expérimental.
|
|
|
|
$\bullet$ Nommer les différents constituants du montage présents dans le doc 1.
$\bullet$ Mettre en œuvre le protocole décrit dans le doc 2.
$\bullet$ Rappeler la relation liant la masse, le volume et la masse volumique.
$\bullet$ En déduire la masse d'eau vaporisée.
$\bullet$ Calculer la valeur du transfert thermique $Q_{ \ ballon}$ fourni par le chauffe-ballon.
$\bullet$ Calculer la valeur de l'énergie massique de vaporisation de l'eau $L_{ \ exp}$.
$\bullet$ Comparer cette valeur à la valeur théorique $L_{ \ eau} \ = \ 2,3.10^{ \ 6} \ J.kg^{ \ -1}$.
$\bullet$ Identifier les éventuelles raisons de la différence observée.
Exercices : P115 à 121
8 ; 9 ; 10 ; 12 ; 13 ; 14 ; 16 ; 26 ; 28 ; 29 ; 31
COURS
C1. Changement d'état.
C11. Changement physique.
|
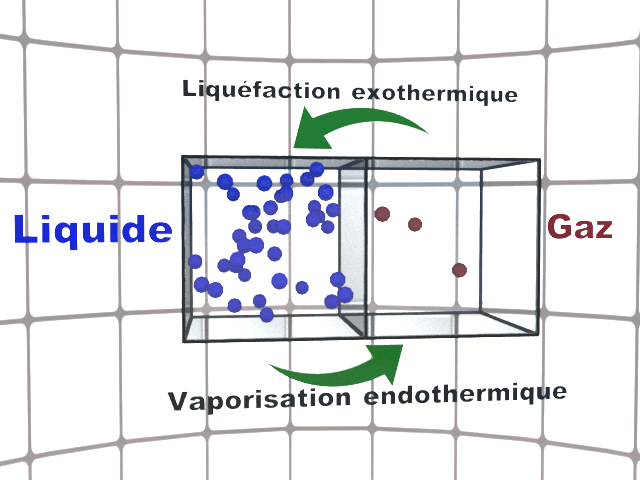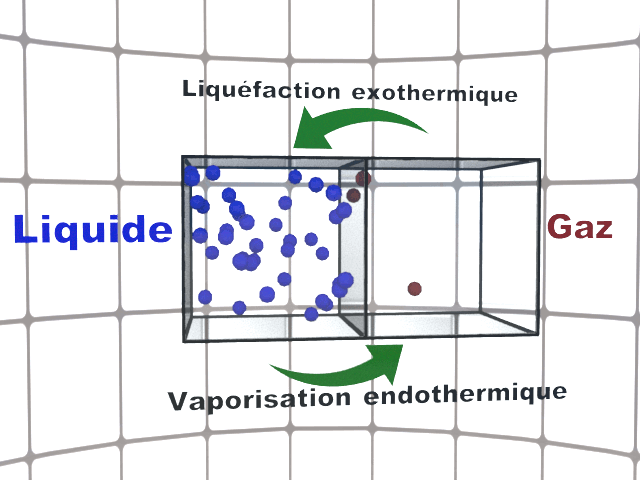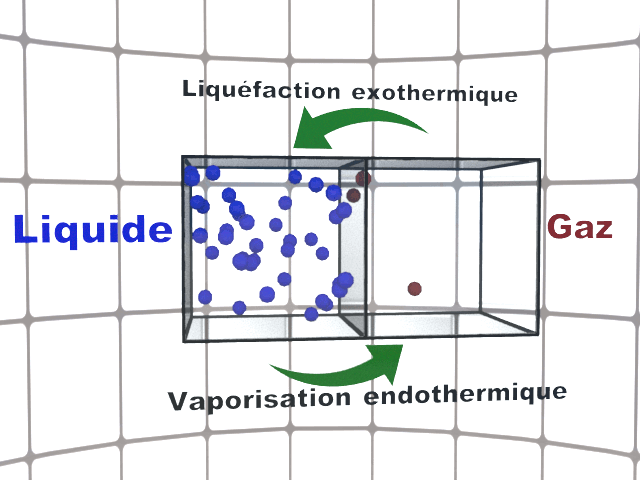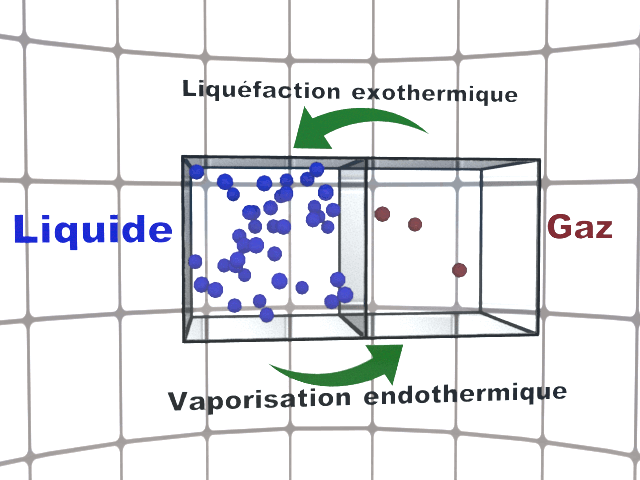
La matière existe sous trois états physiques : $\bullet$ Solide. $\bullet$ Liquide. $\bullet$ Gazeux.
La transformation physique d'un système correspond au passage d'un état à l'autre.. Lors d'un changement d'état, les espèces chimiques concernées sont conservées. Pour un système fermé, les quantités se conservent. |
 |
C12. Modélisation microscopique.
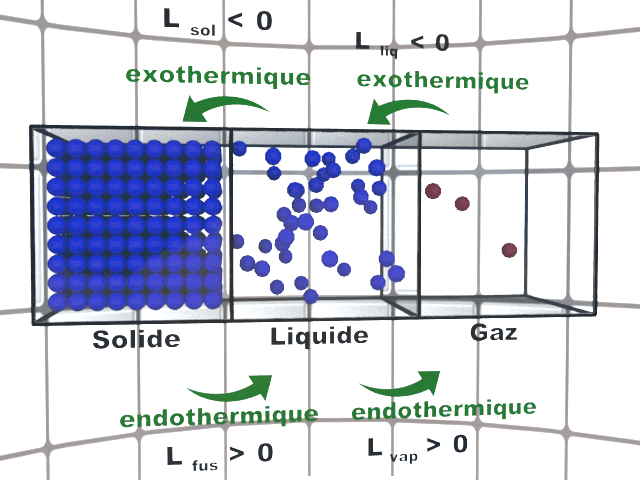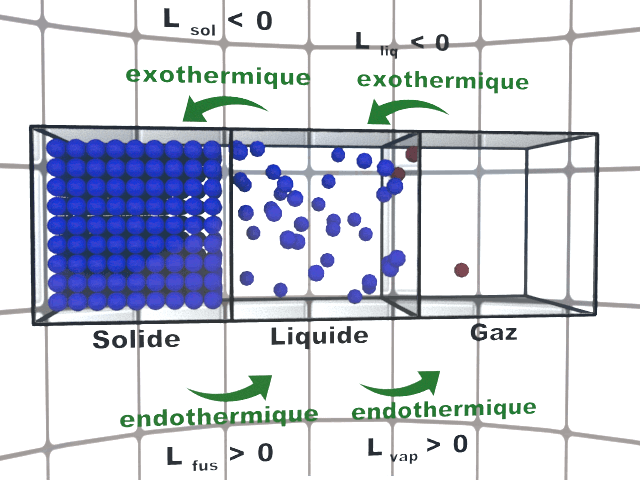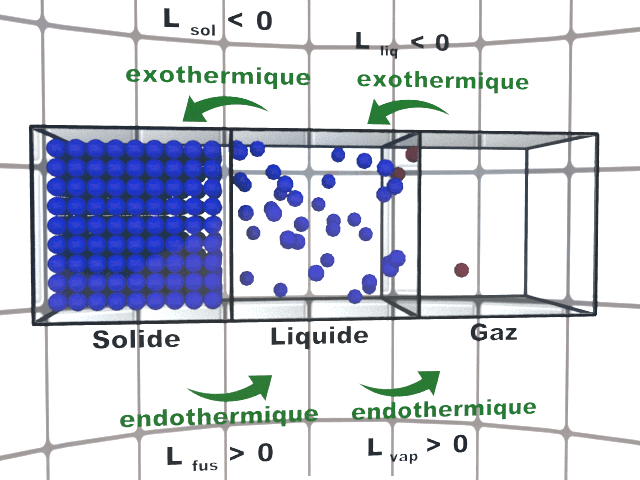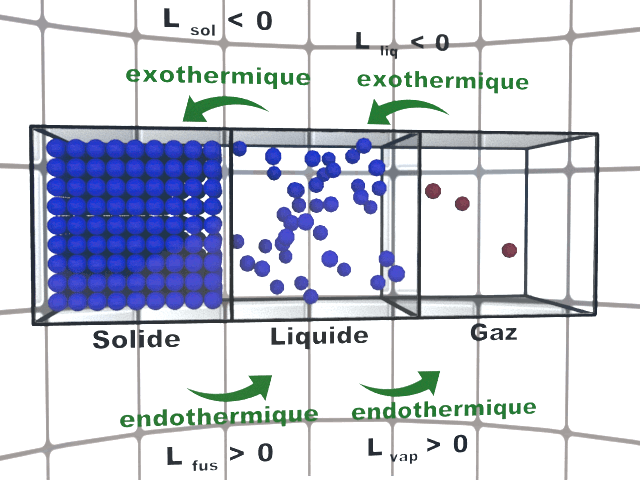 |
L'état gazeux est dispersé. Les états liquide et solide sont condensés : les distances entre les entités sont de l'ordre de grandeur des dimensions des entités..
Pour un corps pur, le changement d'état s'effectue à température constante. Pendant ce changement, les espèces coexistent sous leurs deux formes.
Cette propriété est particulière aux corps purs, elle permet de la caractériser. Les températures de changement d'état sont propres au corps pur étudié. |
C13. Ecriture symbolique.
$\bullet$ Le changement d'état d'un corps pur est symbolisé de la même façon qu'une réaction chimique.
$\bullet$ L'état physique est indiqué en indice par une lettre entre parenthèses.
Exemples :
$\bullet$ Fusion de l'eau : $H_2O_{(s)} \ \longrightarrow \ H_2O_{l}$
$\bullet$ Vaporisation du diazote : $N_{2,(s)} \ \longrightarrow \ N_{2,(g)}$
$\bullet$ Solidification du sulfate de cuivre : $CuSO_{4,(l)} \ \longrightarrow \ CuSO_{4,(l)}$
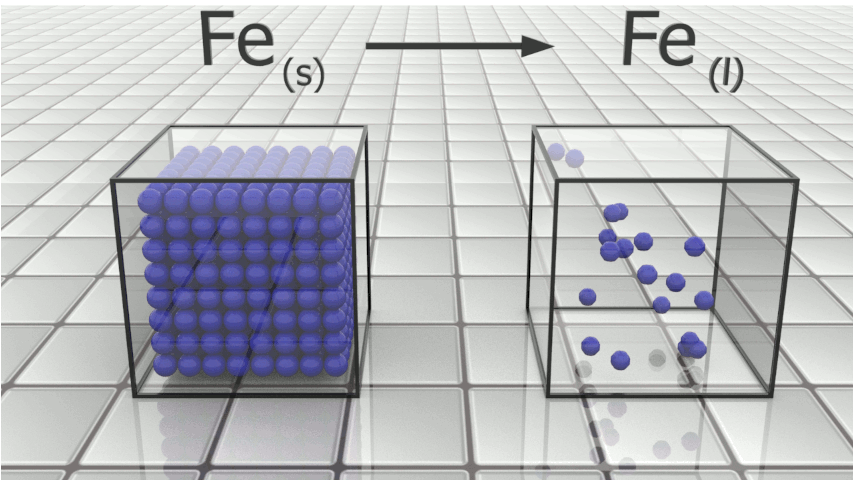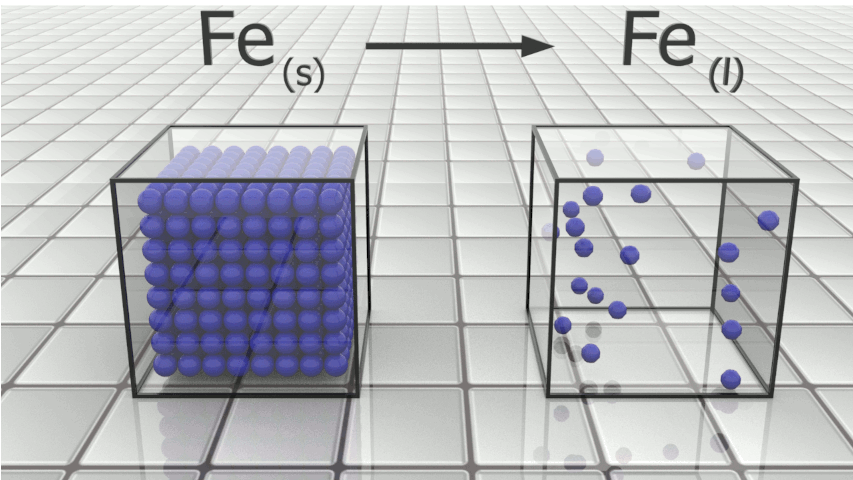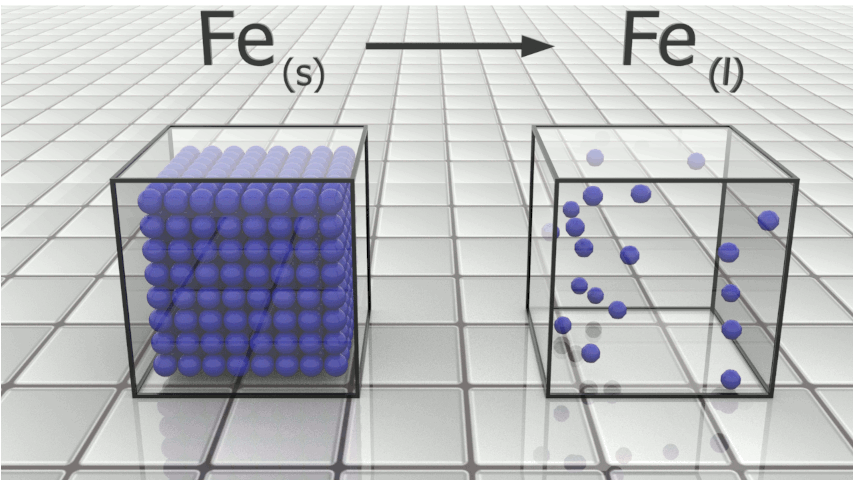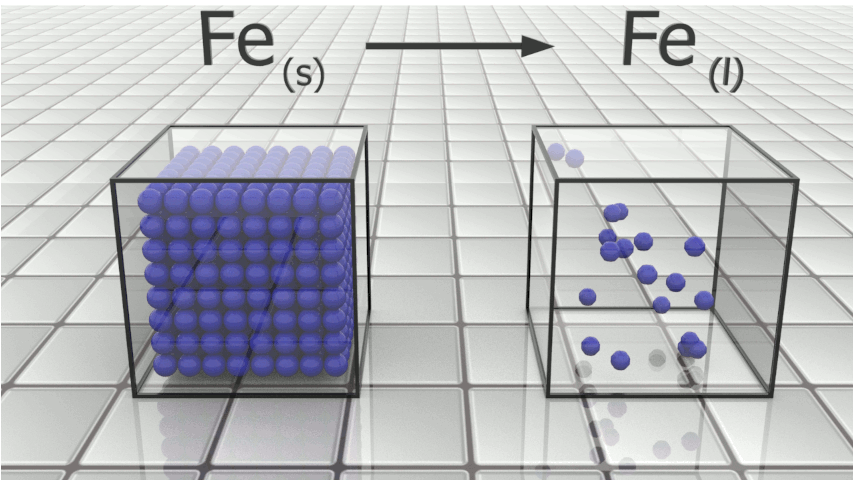
C14. Différence entre fusion et dissolution.
$\bullet$ Lors d'une fusion, il y a transformation du système de l'état solide à l'état liquide. C'est un changement d'état.
$\bullet$ Lors d'une dissolution, l'espèce considérée est toujours conservée, mais elle nécessite l'intervention d'une autre espèce.
$\bullet$ Dans une équation de dissolution en milieu aqueux, l'espèce dissoute est suivie de (aq) (pour "aqueux").
Exemples :
|
Modélisation : |
|
|
Fusion du fer : $Fe_{(s)} \ \longrightarrow \ Fe_{(l)}$ |
 |
|
Dissolution du saccharose : : $C_{12}H_{22}O_{11,(s)} \ \longrightarrow \ C_{12}H_{22}O_{11,(aq)}$ |
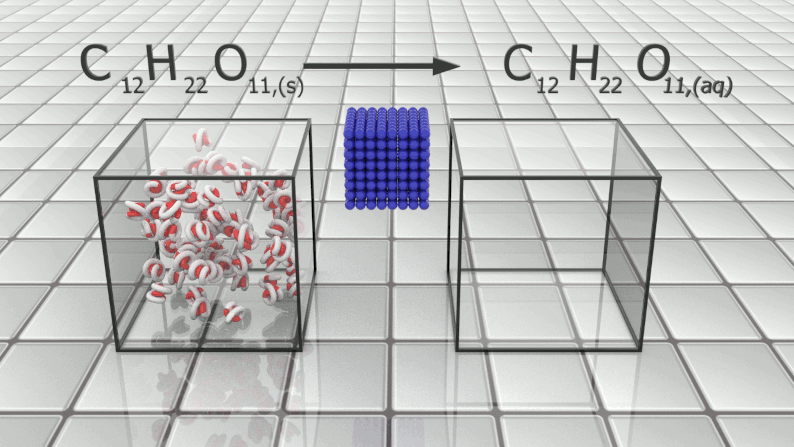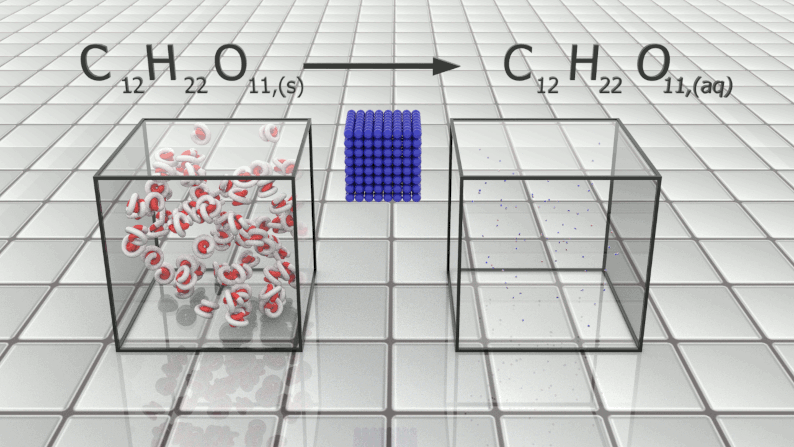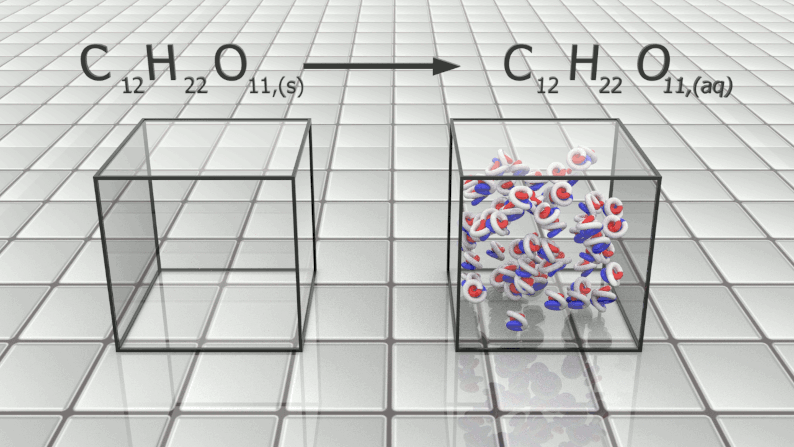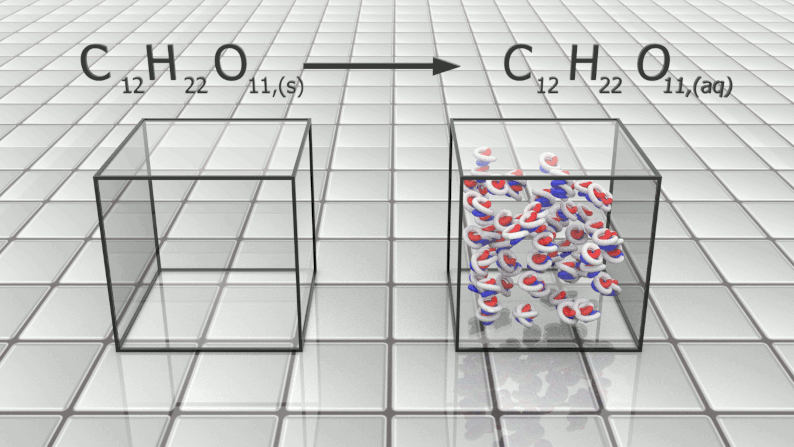 |
C2. Changement d'état et énergie.
C21. Transformations endothermique et exothermique.
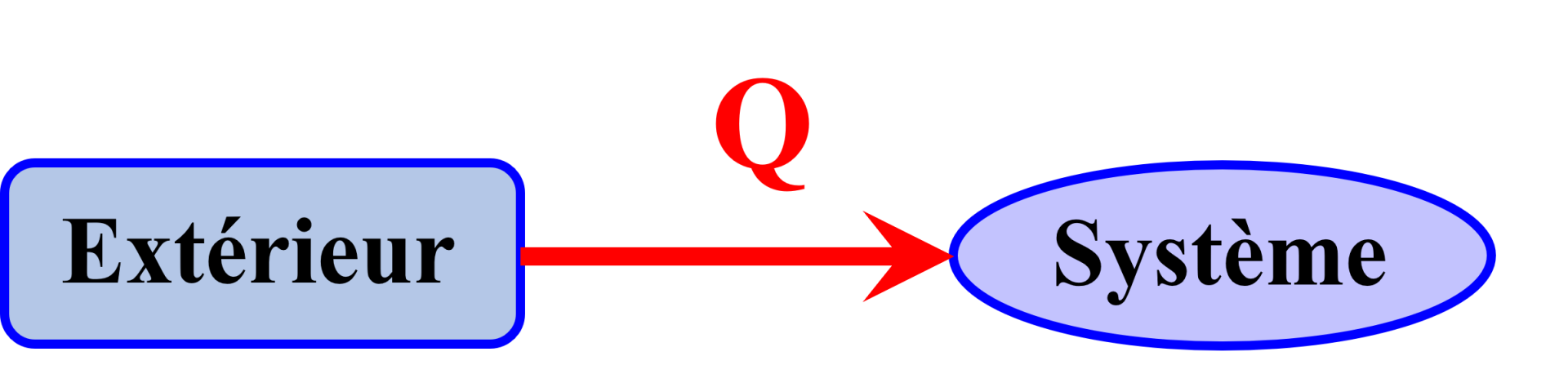
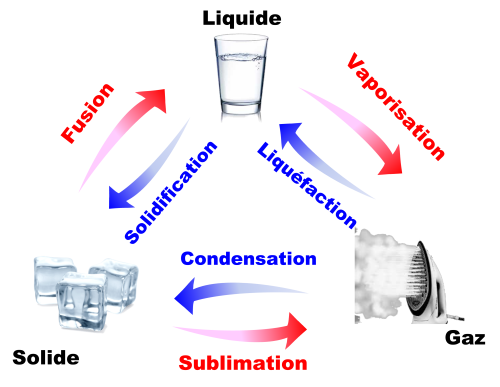
$\bullet$ Un changement d'état d'un système (à température constante) est endothermique si le système reçoit de l'énergie par transfert thermique.
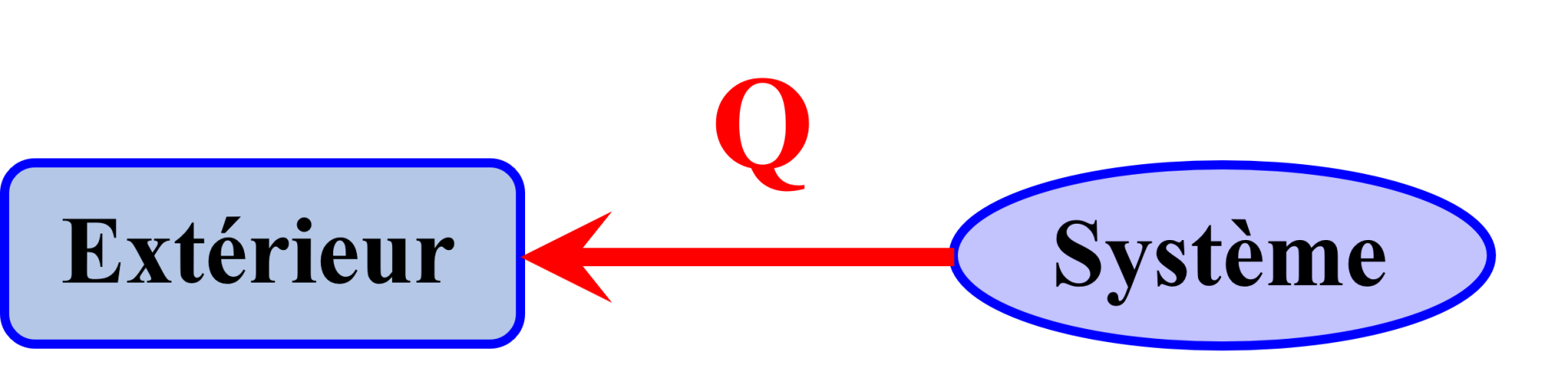
$\bullet$ Un changement d'état d'un système (à température constante) est exothermique si le système cède de l'énergie par transfert thermique.
|
La fusion, la vaporisation et la sublimation sont des transferts d'état endothermiques : le système reçoit de l'énergie par transfert thermique.
|
La solidification, la liquéfaction et la condensation sont des transferts d'état exothermiques : le système cède de l'énergie par transfert thermique.
|
C22. Energie massique de changement d'état.
L'énergie Q échangée par transfert thermique lors d'un changement d'état est proportionnelle à la masse m du système et à la grandeur L, énergie massique propre au type de changement (fusion, vaporisation…).
$Q \ = \ m \ \times \ L$
Q : énergie en joule (J)
m : masse en kilogramme (kg)
L : énergie massique de changement d'état ($J.kg^{ \ -1}$)
NB :
L'énergie massique reçue par un système lors d'un changement de l'état 1 vers l'état 2 est égale à l'énergie massique lors du changementde l'état 2 vers l'état 1
$\bullet \ L_{\ fusion} \ = \ - \ L_{\ solidification}$
$\bullet \ L_{\ vaporisation} \ = \ - \ L_{\ liquéfaction}$
$\bullet \ L_{\ condensation} \ = \ - \ L_{\ sublimation}$
Ajouter un commentaire