Solutions Aqueuses
A2. Concentrations massique et molaire.
A21. Concentration massique.
|
Définition : La concentration massique d'une espèce en solution correspond à la masse de cette espèce dans un litre d'eau. $c_m \ = \ \dfrac{m}{V}$ $m$ : masse en grammes (g). $V$ : volume en litres (L). $c_m$ : concentration massique en (g/L). |
 |
Ci-dessus, l'étiquette d'une bouteille minérale.
$\bullet$ Rappeler les formules des ions présents dans cette eau :
|
Cations |
Anions |
||
|
Calcium : |
|
Chlorure : |
|
|
Magnésium : |
|
Nitrate : |
|
|
Sodium : |
|
Sulfate : |
|
|
Potassium : |
|
Bicarbonate: |
|
$\bullet$ Donner leurs concentrations en $g/L$ :
|
Cations |
Anions |
||
|
Calcium : |
|
Chlorure : |
|
|
Magnésium : |
|
Nitrate : |
|
|
Sodium : |
|
Sulfate : |
|
|
Potassium : |
|
Bicarbonate: |
|
A22. Concentration molaire.
$\bullet$ Pour chaque ion, calculer la quantité de matière correspondante :
|
Cations |
Anions |
||
|
Calcium : |
|
Chlorure : |
|
|
Magnésium : |
|
Nitrate : |
|
|
Sodium : |
|
Sulfate : |
|
|
Potassium : |
|
Bicarbonate: |
|
$\bullet$ Compléter la phrase ci-dessous :
|
La concentration corresponda à la de matière contenue dans de solution aqueuse. |
Définition :
|
Définition : La concentration molaire d'une espèce en solution correspond à la quantité de matière de cette espèce dans un litre d'eau. $ c \ = \ \dfrac{n}{V}$ n : quantité de matière en mole (mol) V : volume en litre (L) C : concentration molaire en mol par litre (mol/L) |
A22. Relation entre les deux grandeurs.
$C \ = \ \dfrac{c_m}{c}$
$\bullet$ Rappeler les unités de chaque grandeur dans la relation ci-dessus.
$\bullet$ On considère une solution d'acide chlorhydrique $(HCl)$ de concentration $c = 0,10 \ mol/L$. Déterminer sa concentration massique $c_m$.
$\bullet$ On considère une solution de nitrate d'argent $(AgNO_3)$ de concentration massique $c_m = 10 \ g/L$. Déterminer sa concentration molaire $c$.
A2. Concentrations massique et molaire.
Gérard doit préparer différentes solutions de sulfate de cuivre pour son professeur de laboratoire Ginette.

A31. Première solution : la solution mère.
Ginette a besoin d'un volume $V = 100 \ mL$ de solution de concentration massique : $c_m = 0,25 \ g/L$
|
Protocolefourni par Ginette : $\bullet$ Peser une masse $m = 2,5 \ g$ de sulfate de cuivre pentahydraté $CuSO_4,5H_2O$à l'aide d'une capsule et d'une balance. $\bullet$ Introduire le solide dans une fiole jaugée de volume$ V = 100 \ mL$. $\bullet$ Rincer la capsule dans la fiole. $\bullet$ Introduire de l'eau distillée dans la fiole. $\bullet$ Agiter pour homogénéiser la solution. $\bullet$ Compléter la fiole à $100 \ mL$, agiter et fermer la fiole. |
 |
$\bullet$ Préciser les mesures de sécurité à respecter.
$\bullet$ Mettre en œuvre le protocole fourni.
A32. Vérification.
$\bullet$ Calculer la concentration massique de la solution préparée par Gérard.
$\bullet$La solution ainsi préparée est-elle celle attendue ?
A33. Correction.
$\bullet$ Calculer le rapport $\dfrac{c_{solution \ attendue}}{c_{solution \ préparée}}$.
$\bullet$ Compléter les phrases :
|
La solution préparée est plus que la solution attendue. Gérard doit diluer la solution préparée. |
$\bullet$ Comment procéder pour obtenir la bonne solution ?
A4. Détermination de la concentration d'une solution.
Ginette doit maintenant déterminer le degré d'acidité d'un vinaigre.
Sur la bouteille, le degré d'acidité annoncé est : d = 8°.
Elle choisit de vérifier cette valeur en effectuant un double dosage :
pH-métrique et conductimétrique.
$\bullet$ Le degré d'acidité correspond à la masse d'acide dans 100 g de solution.
$\bullet$ Le vinaigre utilisé sera dilué 10 fois.
$\bullet$ La solution titrante sera une solution de soude à la concentration cb = 0,1 mol/L.
$\bullet$ On ajoutera un indicateur coloré permettant de repérer "l'équivalence".
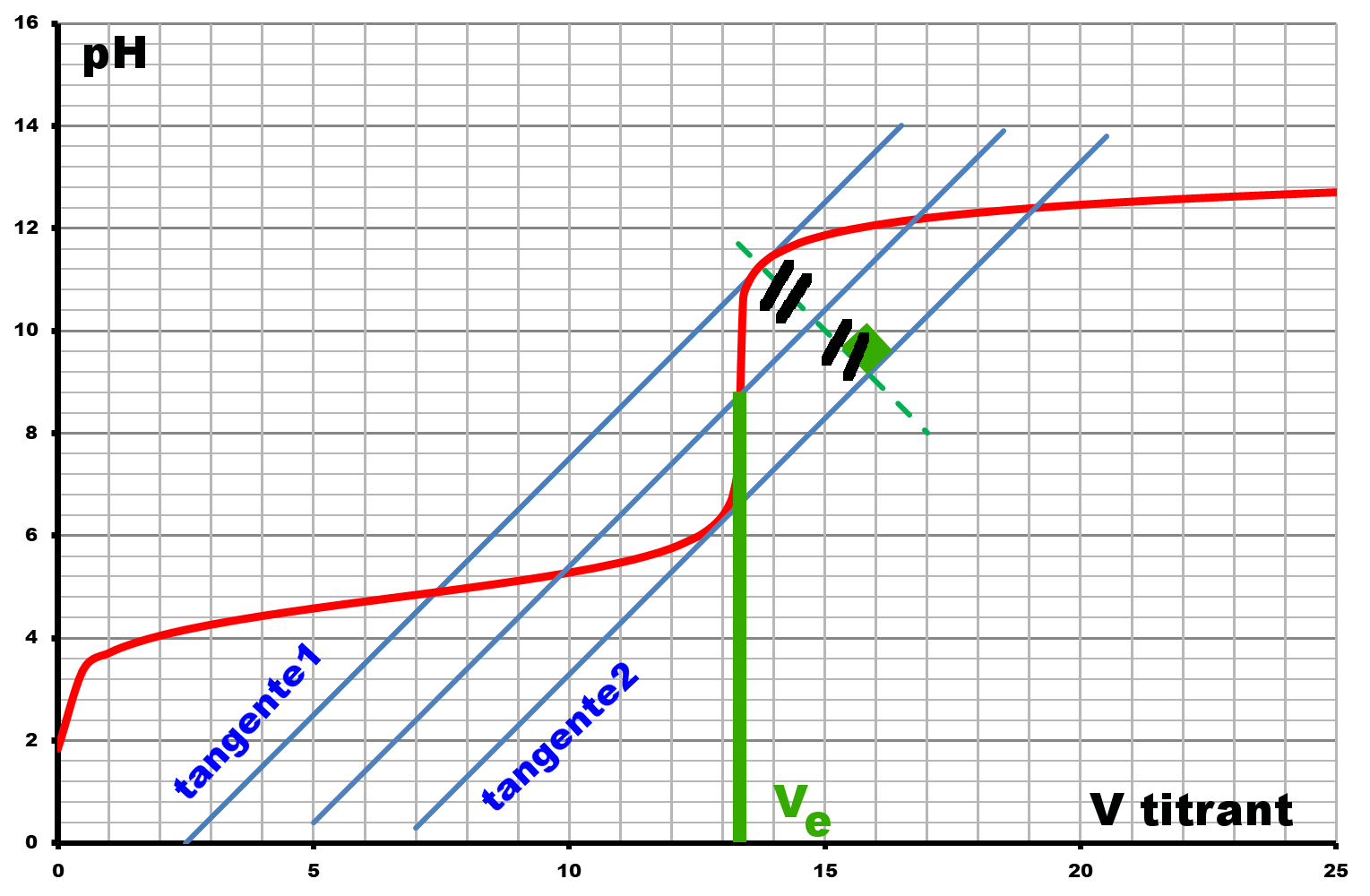
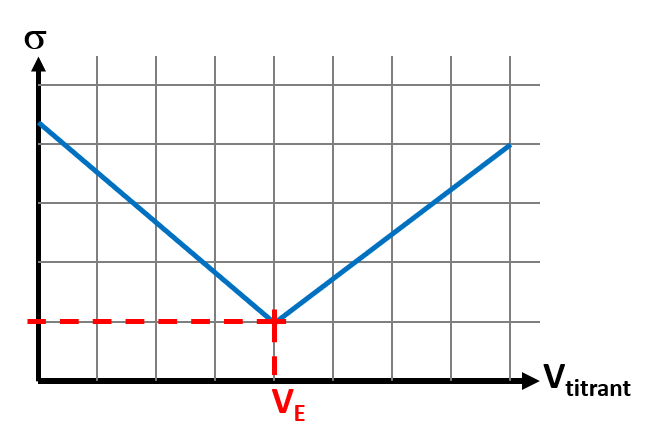
$\bullet$ Pour chaque méthode, on représentera la courbe représentant les variations de la grandeur mesurée (pH ou conductance) en fonction du volume de soude versée.
|
|
|
Calcul du degré du vinaigre : $\bullet$ La concentration molaire en acide acétique est : $c_{acide} \ = \ 10 \times \dfrac{c_{soude} \times V_e}{V_{vinaigre}}$ $\bullet$ La concentration massique en acide acétique est : $c_{m} \ = \ 60 \times c_{acide}$ $\bullet$ La concentration massique en acide acétique est : $d \ = \ 6 \times c_{acide}$ |
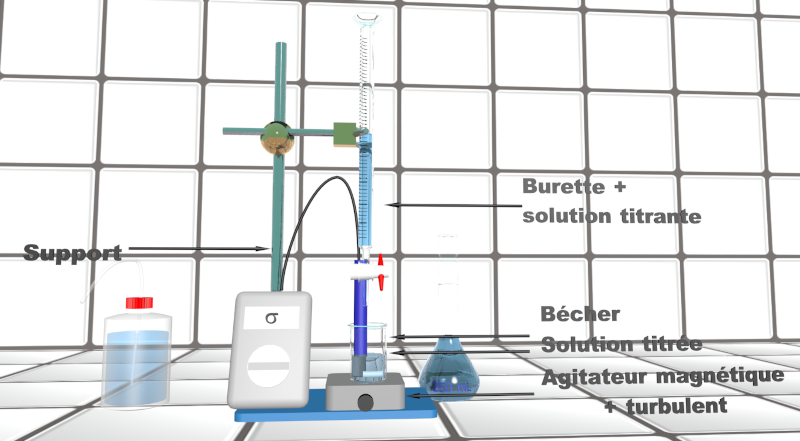
A41. Mesures.
$\bullet$ Faites vérifier votre montage par l'enseignant.
$\bullet$ Effectuer les mesures.
$\bullet$ Représenter les courbes de variations du pH et de la conductance en fonction du volume de soude versée en utilisant un logiciel adapté.
A42. Exploitation des résultats.
$\bullet$ Donner la valeur du volume équivalent dans les deux cas.
$\bullet \ \ V_{e,pH} \ = ..........$
$\bullet \ \ V_{e, \sigma} \ = ......... $
$\bullet$ Calculer le degré du vinaigre dans les deux cas..
$\bullet \ \ d_{pH} \ = ..........$
$\bullet \ \ d_{\sigma} \ = ......... $
$\bullet$ Comparer les valeurs obtenues à celle indiquée.
EXERCICES : 6 ; 7 ; 11 ; 12 ; 13 ; 15 ; 17 P 162 à 166
Ajouter un commentaire