Composition d'une eau
ACTIVITES
A1. Histoire de la composition de l'eau.
A11. S'approprier.
|
|
Doc2 : Expérience.
On introduit de l'eau salée dans une cuve à électrolyse. Sur chaque électrode, on place un tube à essai gradué rempli de cette même eau. On relie les électrodes à une source de courant. |
• Donner la formule chimique de l'eau.
A12. Réaliser - Analyser
• Mettre en place la manipulation décrite dans le doc2.
• Qu'observe-t-on ? • Laisser le processus quelques minutes.
• Mesurer • Comparer les mesures obtenues.
• Expliquer alors la formule chimique de l'eau.
A2. Analyse d'eaux.
|
Doc1 : Une étiquette particulière.
|
|
Doc2 : Différentes eaux.
|
|
Doc3 : Tests. La mise en évidence d’ions en solution s’effectue à l’aide de réactifs appropriés :
|
A21. S'approprier.
• A l'aide de la classification périodique des éléments, nommer les trois premiers éléments de l'étiquette du doc1.
• Comparer les notations proposées sur l'étiquette et celles de la classification.
• Comment se nomment ses espèces ?
• Quelle est la différence entre ces espèces et celles présentes dans la classification ?
• Donner la composition de l'espèce $Cl^{ \ -}$ et de l'espèce $SO_4^{ \ 2-}$.
A22. Réaliser.
 |
|
|
Evian :
|
Badoit :
|
Robinet :
|
Pluie :
|
A23. Mettre en évidence le dioxyde de carbone.
 |
|
A3. L'eau est-elle un bon conducteur ?
Expérience.
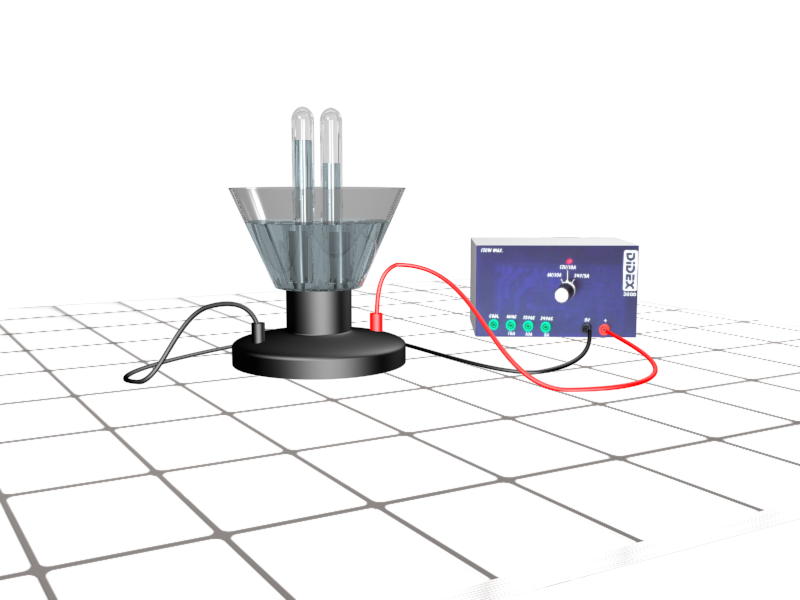 |
Reprendre le montage de l'expérience de la première activité en mettant de l'eau pure dans la cuve. |
• Proposer un moyen de vérifier si l'eau conduit le courant électrique.
• Faire valider par l'enseignant. • Mettre en œuvre et conclure.
• Reprendre l'expérience en remplaçant l'eau par de l'eau salée.
• Comparer, expliquer.
A4. Un café avant le départ.
|
|
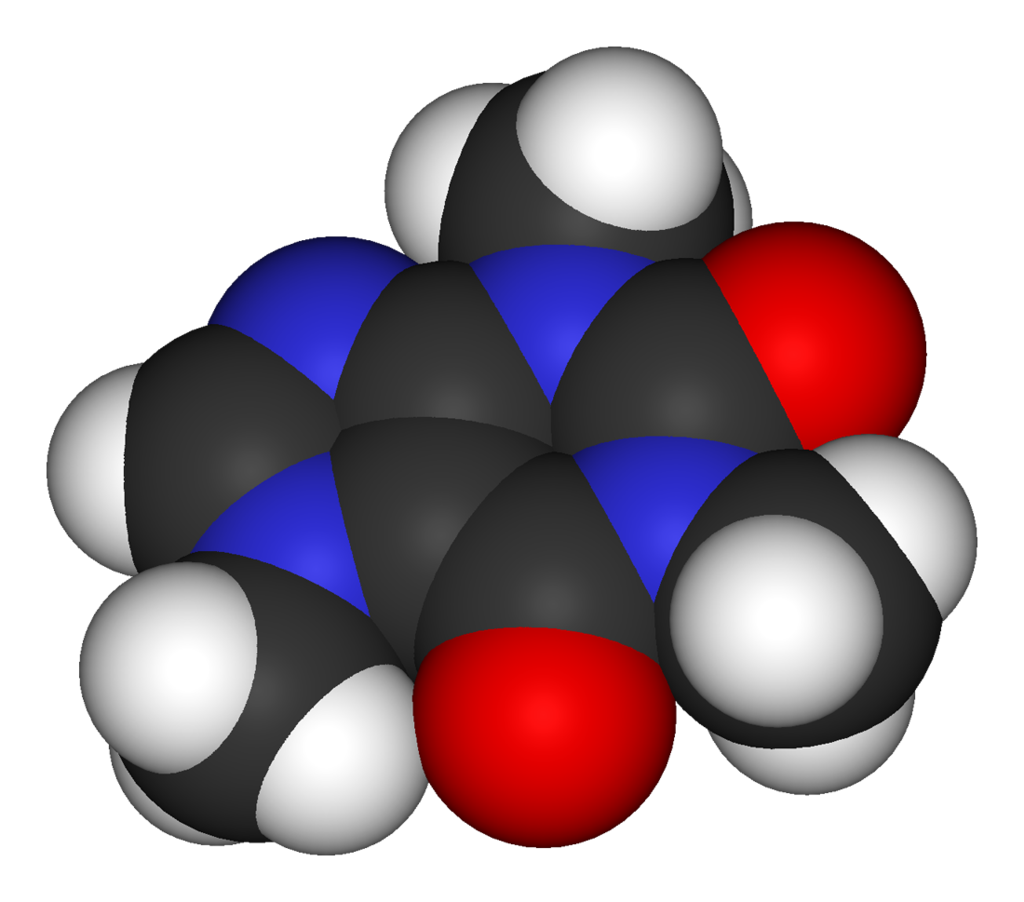
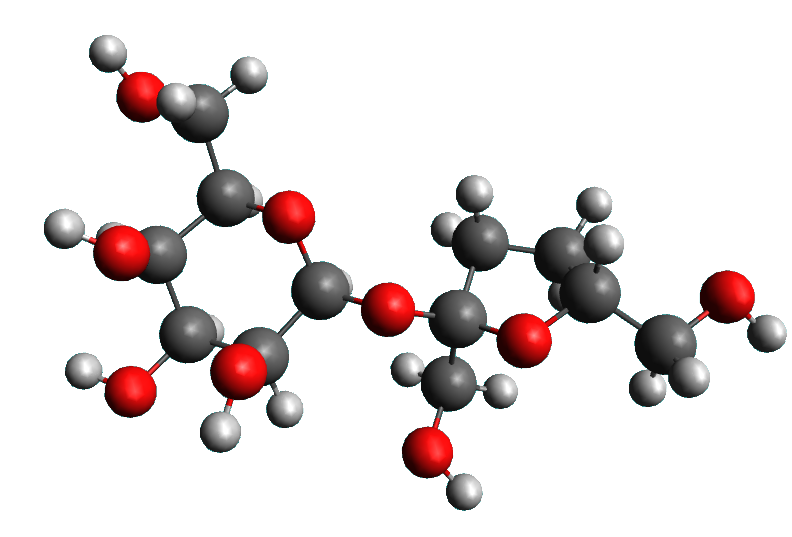
Doc 2 : Représentations. Dans les représentations ci-dessous, les atomes de carbone sont représentés en noir, ceux d'hydrogène en blanc, ceux d'oxygène en rouge et ceux d'azote en bleu.
|
• Ecrire les formules brutes de chaque molécule du doc 2.
• A l'aide d'une recherche, déterminer la formule brute de la caféine et celle du saccharose.
• Déterminer la masse de caféine engloutie par Paul lorsqu'il boit un café.
• Calculer la concentration massique du café en caféine et en saccharose.
COURS
C1. Le fondement de la matière.
C11. L'atome.
|
· C'est la plus petite unité de base de la matière. · Il est constitué :
|
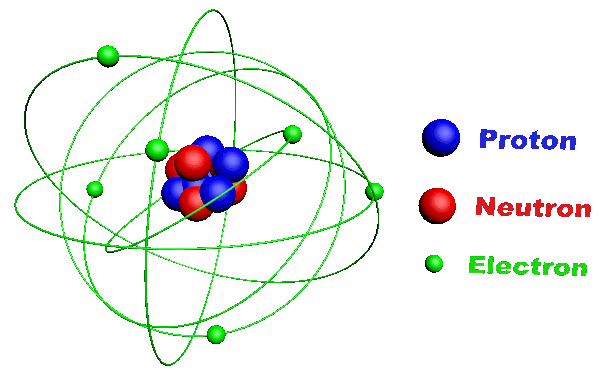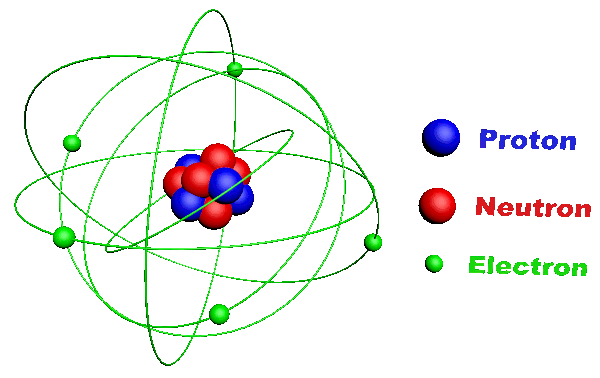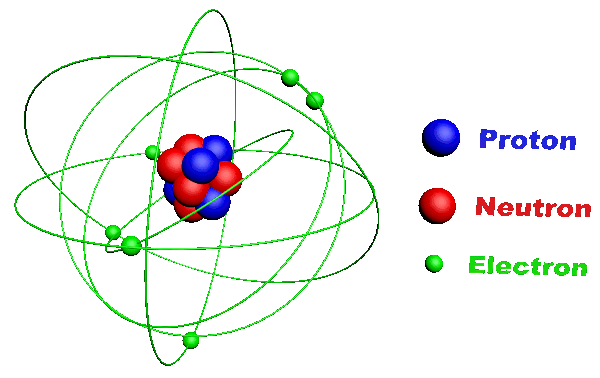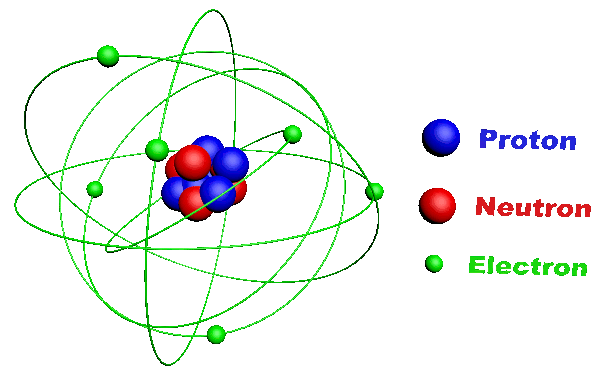 |
C12. Les éléments de la matière.
|
· Un élément est défini par son numéro atomique correspondant à son nombre de protons Z. · Il existe une centaine d'éléments qu'on retrouve dans la classification périodique des éléments (classification de Mendeleïev). · Ils y sont classés selon leur numéro atomique. · Chacun est y représenté par son symbole. · Les éléments de la dernière colonne sont appelés "gaz rares" ou "gaz nobles", ils n'existent que sous forme monoatomique. |
  |
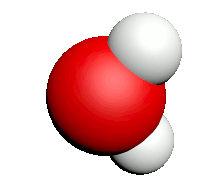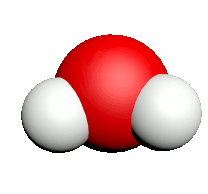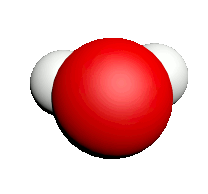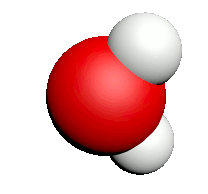
C2. Les molécules.
• Une molécule est un assemblage d'atomes reliés entre eux par des liaisons covalentes.
• Une molécule est constituée d'au moins deux atomes.
• Les atomes étant électriquement neutre, une molécule est aussi électriquement neutre.
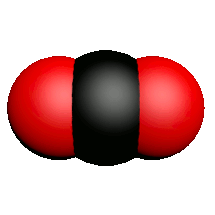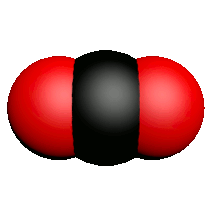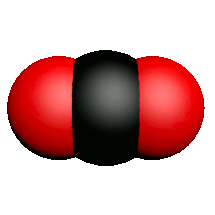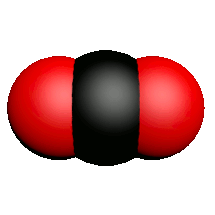
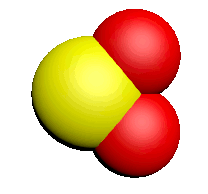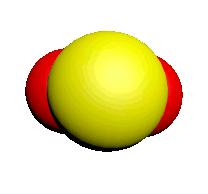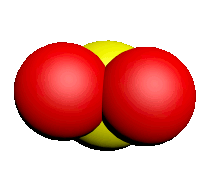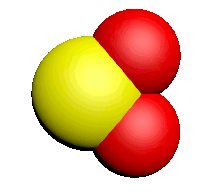
| Nom | Dioxygène | Diazote | Chlorure d'hydrogène | Eau | Dioxyde de carbone | Ammoniac | Dioxyde de soufre |
| Formule | $O_2$ | $N_2$ | $HCl$ | $H_2O$ | $CO_2$ | $NH_3$ | $SO_2$ |
| Modèle |  |
 |
 |
 |
 |
 |
 |
C3. Les ions.
• Un ion est un atome ou une molécule qui a perdu ou gagné un ou plusieurs électrons.
• Un cation est chargé positivement (perte d'électrons).
Exemples : l'ion calcium $Ca^{ \ 2+}$, l'ion sodium $Na^{ \ +}$, l'ion cuivre II $Cu^{ \ 2+}$, l'ion hydronium $H_3O^{ \ +}$.
• Un anion est chargé négativement (gain d'électrons).
Exemples : l'ion chlorure $Cl^{ \ -}$, l'ion sulfate $SO_4^{ \ 2-} $ , l'ion hydrogénocarbonate $HCO_3^{ \ -}$ .
NB : les ions ne sont pas électriquement neutres.
C4. Une solution aqueuse.
C41. Définitions.
• Une solution aqueuse est un mélange obtenu par dissolution d'un produit chimique (gaz ou solide) dans de l'eau.
• L'eau est le solvant.
• L'espèce dissoute est le soluté.
C42. Tests d'identification.
• Identification de molécules :
- Le sulfate de cuivre $CuSO_4$ colore la solution aqueuse en bleu.
- L'eau de chaux se trouble en présence de dioxyde de carbone $CO_2$.
• Identification des ions :
| Réactif | Ions réagissant | Précipité |
| Chlorure de baryum | Ions sulfate $SO_4^{ \ 2-}$ | Blanc |
| Nitrate d'argent | Ions chlorure $Cl^{\ -} $ | Blanc qui noircit à la lumière |
| Oxalate d'ammonium | Ions calcium $Ca^{ \ 2+}$ | Blanc |
| Soude | Ions fer II $Fe^{ \ 2+}$ | Vert |
| Ions fer III $Fe^{ \ 3+}$ | Rouille | |
| Ions cuivre II $Cu^{ \ 2+}$ | Bleu | |
| Ions zinc $Zn^{ \ 2+}$ | Blanc |
• Concentration massique :
La concentration massique d'une espèce en solution est le rapport de la masse introduite de cette dans le volume d'eau :
$C_m=\dfrac {m}{V}$
La masse m est exprimée en grammes (g).
Le volume V est exprimé en litres (L).
La concentration massique $C_m$ est exprimée en grammes par litre (g/L)
Ajouter un commentaire