Corps purs et mélanges
ACTIVITES
A1. Distinguer les corps purs et les mélanges.
L’observation nous permet de déterminer la forme, la couleur et l'état physique de la matière et de procéder à des classements. L'exercice est plus complexe dans le cas d'un mélange homogène.
Peut-on différencier un corps pur d'un mélange homogène ?
|
Doc1 : Corps purs et mélanges.
|
|
Doc2 : Mélanges homogènes et hétérogènes.
|
A11. S’approprier.
$\bullet$ Pour les cas du doc1., préciser en justifiant s’il s’agit de corps simples ou d’un mélange.
$\bullet$ Pour les cas du doc2., préciser en justifiant s’il s’agit d’un mélange homogène ou hétérogène.
A12. Conclure
$\bullet$ Indiquer comment distinguer à l’œil nu, un mélange homogène d'un mélange hétérogène.
A13. Communiquer.
$\bullet$ Définir les termes corps pur, mélange, mélange hétérogène et mélange homogène.
A2. Quelle eau minérale ?
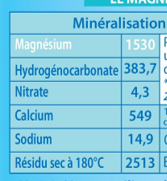
Les eaux minérales contiennent différents ions de natures et en masses différentes.
Selon leur goût, le régime alimentaire du consommateur, celui-ci choisira une eau différente.
Situation : Gérard, serveur au restaurant « Le Canard du Bon Coin Coin » a séparé différentes eaux minérales dans des carafes différentes sans les distinguer.
Comment retrouver l’eau contenue dans chaque carafe ?
|
Doc1 : Etiquettes.
|
Doc2 :Tests caractéristiques. La mise en évidence d’ions en solution s’effectue à l’aide de réactifs appropriés :
|
A21. Analyser / raisonner.
$\bullet$ Proposer une série d’expériences permettant à Gérard d’identifier l’eau contenue dans chaque carafe.
A22. Réaliser.
$\bullet$ Réaliser les expériences et présenter les résultats obtenus.
A23. Valider.
$\bullet$ Attribuer chaque eau minérale à la carafe correspondante.
A3. Quel colorant ?
|
Les colorants alimentaires sont utilisés pour aiguiser notre appétit. Ils sont soumis à une réglementation et doivent être indiqués sur les emballages. |
 |
Quels sont les colorants alimentaires utilisés dans les dragées chocolatées ?
|
Doc1 : La chromatographie sur couche mince (CCM).
|
|
Doc1 : La chromatographie sur couche mince (CCM).
|
A31. Réaliser.
Mettre en œuvre le protocole. Et faire valider par l’enseignant.
A32. Analyser / Raisonner.
$ \bullet$ Quels sont les bonbons dont l’enrobage est constitué d’un corps pur ?
$ \bullet$ Le bleu patenté V est-il présent dans l’enrobage de certains bonbons ?
$ \bullet$ Dans les packs de colorants pâtissiers vendus en grande surface, on ne trouve pas de colorant vert. Expliquer.
A33. Conclusion.
La chromatographie sur couche mince est-elle une technique de séparation ou d’identification ? Justifier.
![]() Exercices 1 (851.88 Ko)
Exercices 1 (851.88 Ko)
COURS
C1. Corps purs et mélanges.
C11. Corps pur.
|
Un corps pur est composé d’une seule espèce chimique, sous forme atomique ou moléculaire. Un "corps pur" se trouvera sous différents états selon la température et la pression du milieu dans lequel il se trouve. |
|
Exemples :
A température et pression ambiantes :
- Le fer $Fe$, le chlorure de sodium NaCl sont à l’état solide.
- L’eau $H_2O$, l’éthanol $C_2H_5OH$ sont à l’état liquide.
- Le dioxygène $O_2$, le benzène $C_6H_6$ sont à l’état gazeux.
C12. Mélange.
|
Un mélange est composé d’au moins deux espèces chimiques. Un mélange est homogène si les deux espèces qui le constituent sont dans le même état physique Dans le cas contraire, on parle de mélange hétérogène. |
|
C13. Composition.
|
La composition d’un mélange indique les proportions de chaque espèce présente dans le mélange |

Casserole en fonte |
Exemples :
$\bullet$ Mélange homogène solide :
La fonte est un composé de carbone et de fer.
Les proportions massiques sont approximativement : $95 \%$ de fer $Fe$ et $5 \%$ de carbone $C$.
Dans une casserole de masse $m_{totale} \ = \ 5 \ kg$ :
- la masse de fer est : $m \left( Fer \right ) \ = \ \dfrac{95}{100} \ \times \ m_{totale} \ = \ \dfrac{95}{100} \ \times \ 5 \ = \ 4,75 \ kg$
- la masse de carbone est : $m \left( Carbone \right ) \ = \ \dfrac{5}{100} \ \times \ m_{totale} \ = \ \dfrac{5}{100} \ \times \ 5 \ = \ 0,25 \ kg$
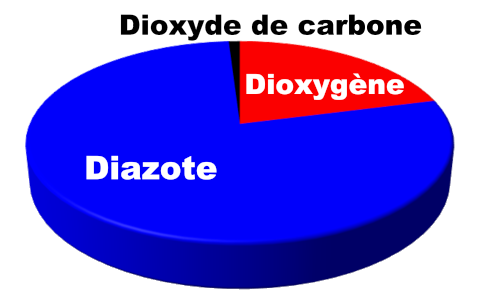
$\bullet$ Mélange homogène gazeux :
|
L’air est un mélange homogène gazeux de plusieurs gaz : - le diazote $N_2$ (78 %) - le dioxygène $O_2$ (21%) - le dioxyde de carbone $CO_2$ (1%) - ……. La masse volumique de l'air est de l'ordre de $1 \ g.L^{ \ -1}$ |
 |
C2. Identification d’espèces chimiques.
C21. Par des mesures physiques.
C21a. Changement d’état.
|
Une espèce possède des propriétés physiques particulières : - Température de fusion $\theta_f$ (passage de l’état solide à liquide) - Température d’ébullition $\theta_{eb}$ (passage de l’état liquide à gazeux). |
|
|||||||||
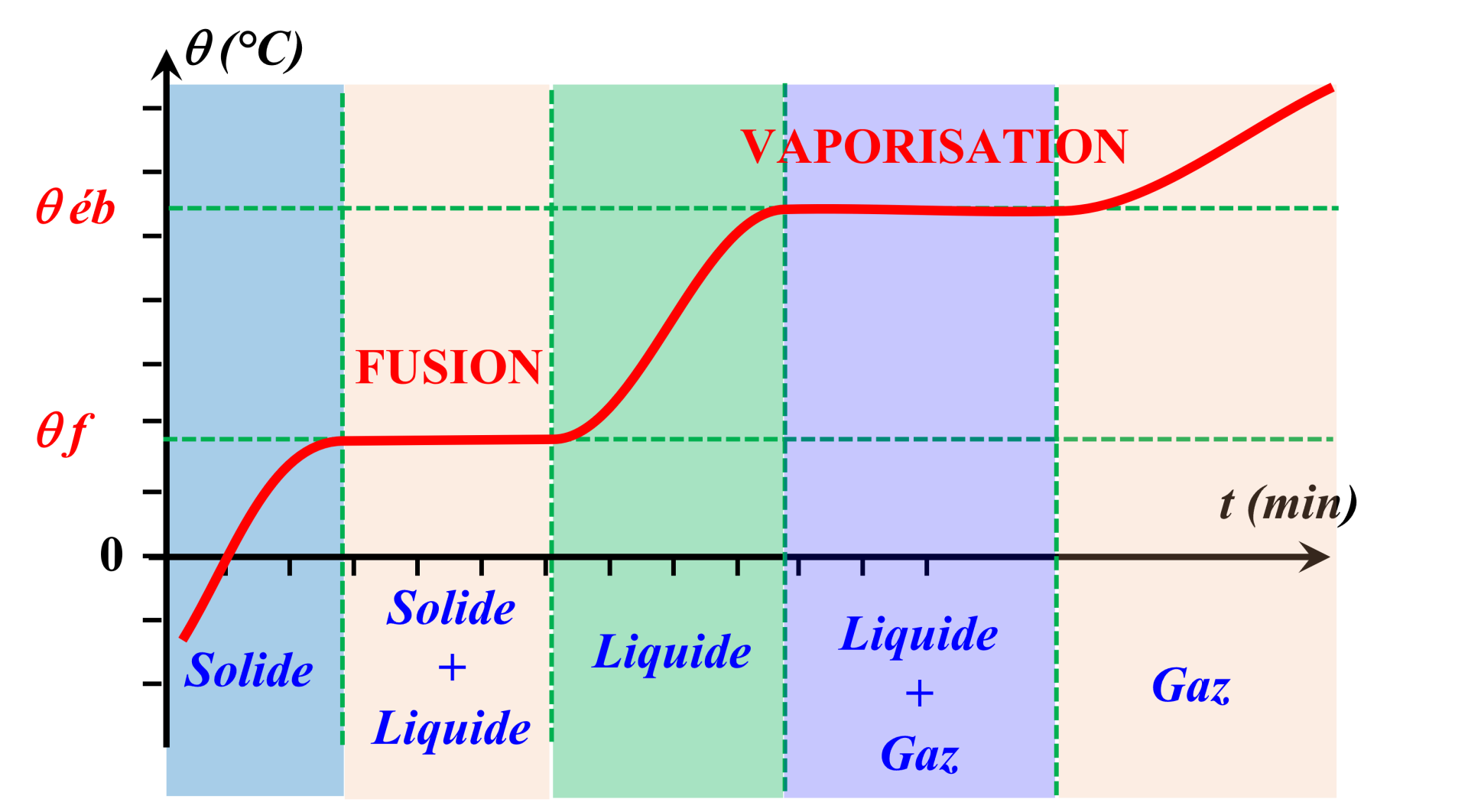 |
Durant un changement d’état, les deux états du corps sont présents. La température reste constante. |
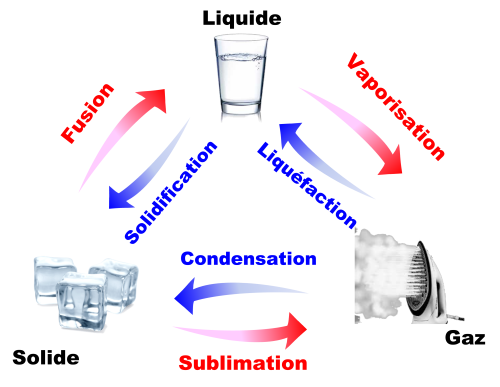 |
 |
C21b. Masse volumique.
|
La masse volumique $\rho$ d’un corps pur est une grandeur caractéristique de ce corps. Cette grandeur est le rapport de la masse au volume :
$\rho \ = \ \dfrac{m}{V}$
Dans le cas où la masse est exprimée en kilogramme ($kg$) et le volume en mètre cube ($m^{ \ 3}$), la masse volumique est exprimée en kilogramme par mètre cube ($kg.m^{ \ -3}$ ou $kg/m^{ \ 3}$) |
|
C22. Par des tests chimiques.
|
Une espèce chimique peut être mise en évidence en utilisant ses propriétés chimiques. Par l’intermédiaire d’une réaction chimique, elle est susceptible de se transformer en une autre espèce caractéristique. Par exemple, certains ions, en réagissant avec d’autres, produisent des précipités colorés. |
 |
Exemples :
|
Ion |
Réactif |
Couleur du précipité |
|
Chlorure, $Cl^{ \ -}$ |
Nitrate d’argent $AgNO_3$ |
Blanc |
|
Sulfate, $SO_4^{ \ 2-}$ |
Chlorure de baryum $BaCl_2$ |
Blanc |
|
Calcium, $Ca^{ \ 2+}$ |
Oxalate d’ammonium $(NH_4)_2C_2O_4$ |
Blanc |
|
Fer II, $Fe^{ \ 2+}$ |
Soude $NaOH$ |
Vert |
|
Fer III, $Fe^{ \ 3+}$ |
Soude $NaOH$ |
Rouille |
|
Cuivre II, $Cu^{ \ 2+}$ |
Soude $NaOH$ |
Bleu |
C23. Par chromatographie.
|
La chromatographie sur couche mince permet d’identifier certaines espèces chimiques présentes dans un mélange liquide homogène. Elle se base sur la différence d’affinité des espèces chimiques entre deux phases. L’éluant entraine verticalement les espèces déposées. Chaque espèce forme une tâche spécifique à une hauteur donnée. Pour un mélange homogène, chaque composant du mélange est entraîné à une hauteur différente. |
 |
Ajouter un commentaire