Solutions aqueuses
ACTIVITES
 |
Lucien, neveu de son tonton Gérard, se prépare à une balade en vélo. Mais Gérard souhaite vérifier que le jus de pomme qu'il possède n'est pas trop sucré. La teneur en sucre ne doit pas dépasser 97 g/L Gérard va tenter de répondre correctement à ses besoins. |
 |
A1. Incertitude de la verrerie.
Pour mesurer un volume, la verrerie doit être choisie en fonction de la précision souhaitée.
Objectif : Gérard souhaite l’incertitude liée à la verrerie à sa disposition pour présenter le meilleur résultat.
|
|
|
|
A11. L'éprouvette.
A11a. Réaliser.
Reporter les valeurs dans le tableau ci-dessous :
|
Mesure |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
$m_{ \ eau}$ (g) |
|
|
|
|
|
|
|
|
|
|
A11b. Valider.
$\bullet$ Calculer le volume d'eau correspondant à chaque mesure.
7
|
Mesure |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
$V_{ \ ep}$ (L) |
|
|
|
|
|
|
|
|
|
|
$\bullet$ Calculer la valeur moyenne $\overline {V_{ \ ep}}$ du volume de l'éprouvette.
$\bullet$ Déterminer l'écart-type $\sigma _{ \ ep}$ correspondant
$\bullet$ Calculer l'incertitude-type $u \left ( V_{ \ ep} \right )$. Ecrire le résultat sous la forme : $V_{ \ ep} \ = \ \overline {V_{ \ ep}} \ \pm \ u \left ( V_{ \ ep} \right )$.
A11. La fiole.
A11a. Réaliser.
Reporter les valeurs dans le tableau ci-dessous :
|
Mesure |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
$m_{ \ eau}$ (g) |
|
|
|
|
|
|
|
|
|
|
A11b. Valider.
$\bullet$ Calculer le volume d'eau correspondant à chaque mesure.
|
Mesure |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
$V_{ \ fiole}$ (L) |
|
|
|
|
|
|
|
|
|
|
$\bullet$ Calculer la valeur moyenne $\overline {V_{ \ fiole}}$ du volume de l'éprouvette.
$\bullet$ Déterminer l'écart-type $\sigma _{ \ fiole}$ correspondant
$\bullet$ Calculer l'incertitude-type $u \left ( V_{ \ fiole} \right )$. Ecrire le résultat sous la forme : $V_{ \ fiole} \ = \ \overline {V_{ \ fiole}} \ \pm \ u \left ( V_{ \ fiole} \right )$.
A13. Communiquer.
Représenter les histogrammes pour les mesures associées à chaque série de mesures. Répondre à la problématique.
A2. La dilution.
Pour réaliser au mieux l'étude du jus de pomme, Gérard souhaite vérifier qu'il sait encore effectuer l'opération de dilution…
Objectif : Evaluer une concentration massique.
|
|
|
Doc 3 : A disposition. $\bullet$ Une solution mère de sulfate de cuivre à la concentration massique : $C_{mère} \ = \ 5,0 \ g.L^{ \ -1}$ utilisée pour les manipulations. $\bullet$ Une fiole de 50 mL de sulfate de cuivre sur laquelle il est indiqué : : $C_{m} \ = \ 1,0 \ g.L^{ \ -1}$ utilisée pour les manipulations. $\bullet$ Des fioles de $50 \ mL$, $100 \ mL$ et $250 \ mL$. $\bullet$ Eprouvettes graduées de $5 \ mL$, $10 \ mL$, $50 \ mL$. |
A21. Analyser.
$\bullet$ Proposer un protocole à mettre en place pour estimer la concentration $C_{m} \ = \ 1,0 \ g.L^{ \ -1}$.
$\bullet$ Déterminer la relation entre les volumes $V_{mère}$, $V_{fille}$, les concentrations massiques $C_{mère}$, $C_{fille}$ des solutions "mère" et "fille".
$\bullet$ Choisir le volume adapté de chaque solution à préparer. Justifier.
$\bullet$ Déterminer les volumes à prélever pour préparer 5 solutions aux concentrations massiques données dans le tableau ci-dessous.
|
Solution |
1 |
2 |
3 |
4 |
5 |
|
$C_{ \ fille} \ (g/L)$ |
0,5 |
1 |
2,5 |
4 |
5 |
|
$V_{ \ fille} \ (L)$ |
|||||
|
$V_{ \ mère} \ (L)$ |
A12. Réaliser.
$\bullet$ Une fois les valeurs déterminées, mettre en œuvre le protocole décrit précédemment.
A13. Communiquer.
Conclure quant à la valeur indiquée sur la fiole où il est indiqué $C_m \ = \ 1,0 \ g.L^{ \ -1}$ .
A3. Dosage par étalonnage.
Effectuer un dosage par étalonnage permet de déterminer la grandeur caractéristique inconnue d’un corps ou d’une solution à partir de corps pour lesquels cette grandeur est connue.
 |
Quelle est la concentration massique en saccharose d’un jus de pomme ? |
 |
|
Doc 1 : Matériel.
|
|
Doc 2 : Défiinitions. $\bullet$ La masse volumique $\rho$ d’une solution est le rapport de la masse $m$ d’une solution à son volume $V$ :
$\bullet$ Pour une solution aqueuse, la concentration massique en soluté $C_m$ correspond à la masse $m$ de soluté par unité de volume V.
|
NB : Bien que ces grandeurs s’expriment dans la même unité, ces grandeurs sont distinctes. L’une dépend de l’autre : la masse volumique d’une solution dépend de la concentration en masse de soluté.
|
|
A31. Analyser.
$\bullet$ Quelles sont les mesures à effectuer pour mesurer la masse volumique de chaque solution ?
$\bullet$ Parmi le matériel proposé, choisir celui qui permettra d’effectuer les mesures les plus précises. Justifier.
$\bullet$ Détailler précisément le protocole pour chaque mesure.
A32. Réaliser.
$\bullet$ Pour chaque solution étalon, effectuer les mesures et compléter le tableau ci-dessous.
|
Solution |
$S_1$ |
$S_2$ |
$S_3$ |
$S_4$ |
|
Masse (g) |
|
|
|
|
|
Volume (L) |
||||
|
Masse volumique $(g/L)$ |
$\bullet$ Reporter les mesures sur le graphique ci-dessous et tracer la courbe d’étalonnage.
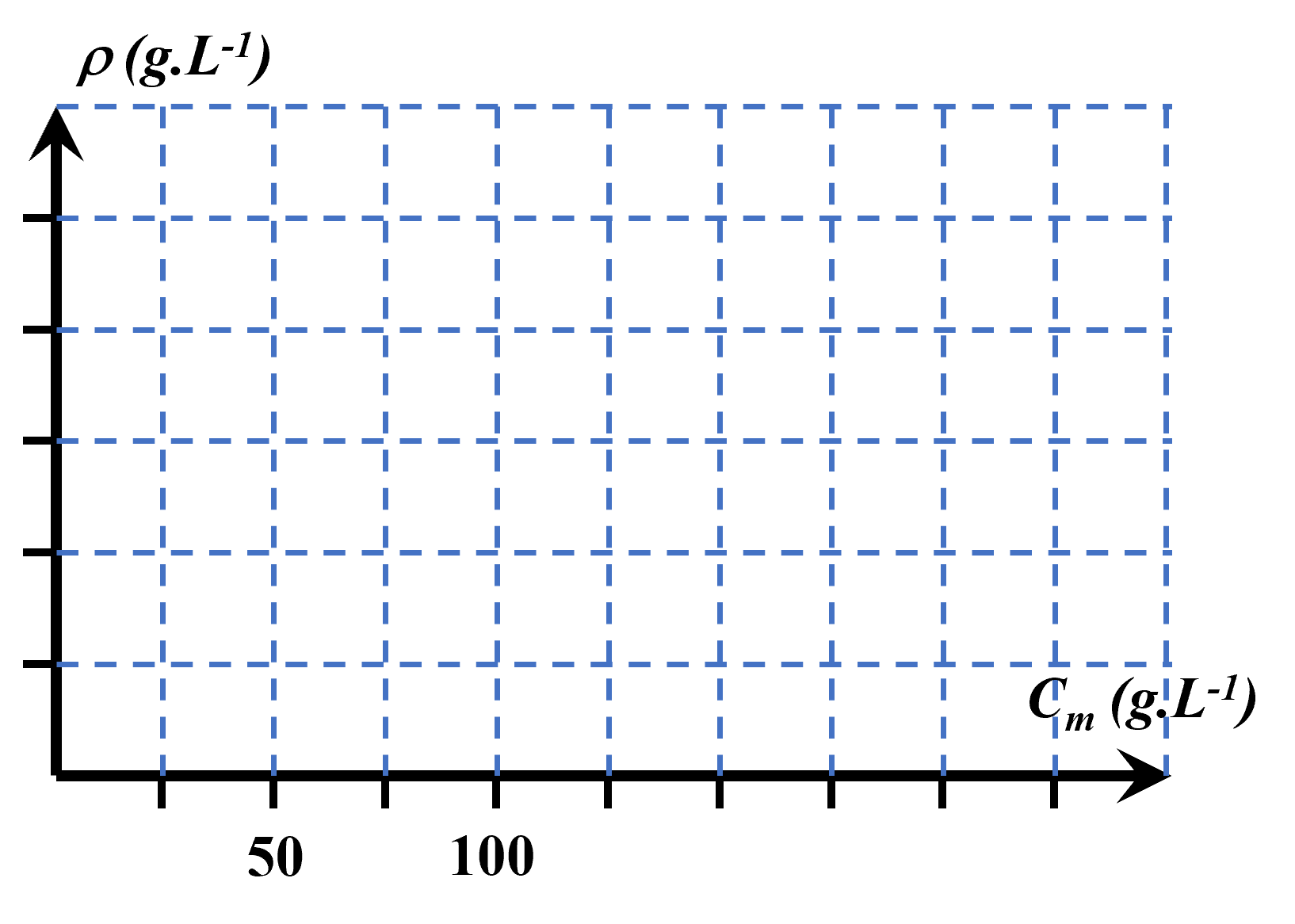
A33. Valider.
$\bullet$ Déterminer la masse volumique du jus de pomme.
$\bullet$ A l’aide de la courbe d’étalonnage, déterminer la concentration massique en saccharose du jus de pomme.
$\bullet$ Gérard peut-il proposer ce jus de pomme à Lucien ?
Exercices (P22 à 35) : 22 ; 23 ; 24 ; 26 ; 30 ; 31 ; 35 ; 39.
COURS
C1. Solution aqueuse.
C11. Définition.
Une solution est un mélange homogène obtenu par dissolution totale d’au moins une espèce appelée SOLUTE dans une autre espèce appelée SOLVANT
.
On parle de solution aqueuse lorsque le solvant est de l’eau.
C12. Concentration en masse.
La concentration en masse $C_m$ de soluté est le rapport de la masse $m$ de soluté dissout au volume $V$ de la solution :
|
$C_m \ = \ \dfrac{m}{V}$ |
$C_m$ : concentration en gramme par litre ($g.L^{ \ -1}$) $m$ : masse en gramme (g) $V$ : volume en litre (L) |
C13. Préparation par dissolution.
La préparation d’une solution en concentration en masse donnée $C_m$, consiste en la dissolution d’une masse $m$ d’un soluté dans un volume $V$ de solvant.
Pour préparer un volume V d’une solution de concentration Cm, il faut déterminer la masse m de soluté à dissoudre : $m \ = \ C_m \ \times \ V$.
Protocole :
|
1. |
 |
Peser la masse déterminée et l'introduire dans une fiole au volume souhaité. |
|
2. |
 |
Ajouter de l’eau |
|
3. |
 |
Agiter pour homogénéiser |
|
4. |
 |
Compléter au volume souhaité, agiter et boucher. |
C14. Préparation par dilution.
La dilution d’une solution mère consiste à diminuer sa concentration en masse pour obtenir une solution fille.
On note $C_{ \ mère}$ la concentration en masse de la solution mère et $C_{ \ fille}$, la concentration en masse de la solution fille.
$\bullet$ La masse $m$ prélevée dans le volume de solution mère reste la même dans la solution fille, donc :
$m \ = \ C_{ \ mère} \times V_{ \ mère} \ = \ C_{ \ fille} \times V_{ \ fille}$
$\bullet$ Le volume Vmère de solution mère à prélever pour obtenir un volume Vfille de solution diluée est donc :
$V_{ \ mère} \ = \ \dfrac{C_{ \ fille} \times V_{ \ fille}}{C_{ \ mère}}$
Protocole :
|
1. |
 |
Verser une partie de la solution mère dans un bécher |
|
2. |
 |
Prélever le volume calculé $V_{ \ mère}$ de solution mère à l'aide d'une pipette au volume souhaitée. |
|
3. |
 |
Introduire ce volume dans une fiole au volume $V_{ \ fille}$ de la solution fille. |
|
4. |
 |
Ajouter de l'au distillée. |
|
5. |
 |
Homogénéiser. |
|
6. |
 |
Compléter au trait de jauge, homogénéiser et boucher. |
C2. Dosage par étalonnage.
C21. Définition.
Le dosage par étalonnage consiste en la détermination de la concentration massique d'une solution aqueuse donnée.
C22. Principe
$\bullet$ On choisit de mesurer une grandeur spécifique à cette solution (absorbance, masse volumique, conductivité…).
$\bullet$ Cette grandeur varie en fonction de la concentration.
$\bullet$ On la mesure pour une gamme de solutions de concentrations connues. Ces solutions sont appelées "solutions étalons".
$\bullet$ Une fois ces mesures effectuées, en mesurant la valeur de la grandeur choisie, on détermine la concentration cherchée pour la solution étudiée.
C23. Types de dosages par étalonnage.
C23a. Le dosage colorimétrique.
Cette méthode est utilisée pour une solution colorée.
 |
La "comparaison" rapide de la transparence de diverses solutions permet d'estimer la concentration à déterminer. |
C23b. Le dosage par mesure.
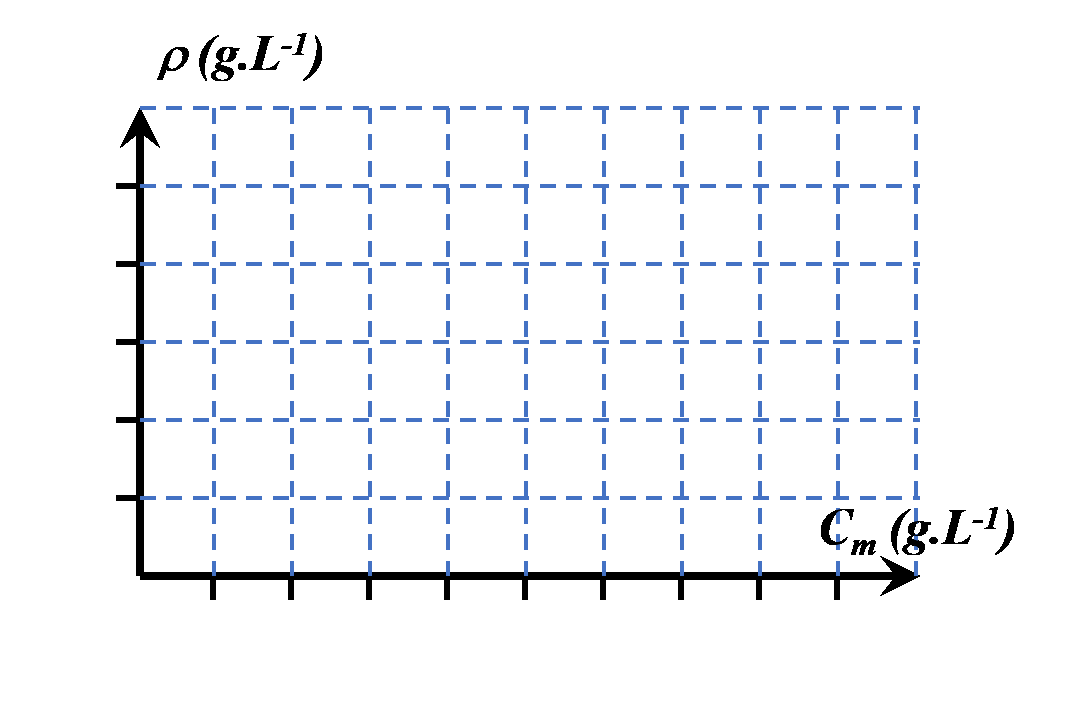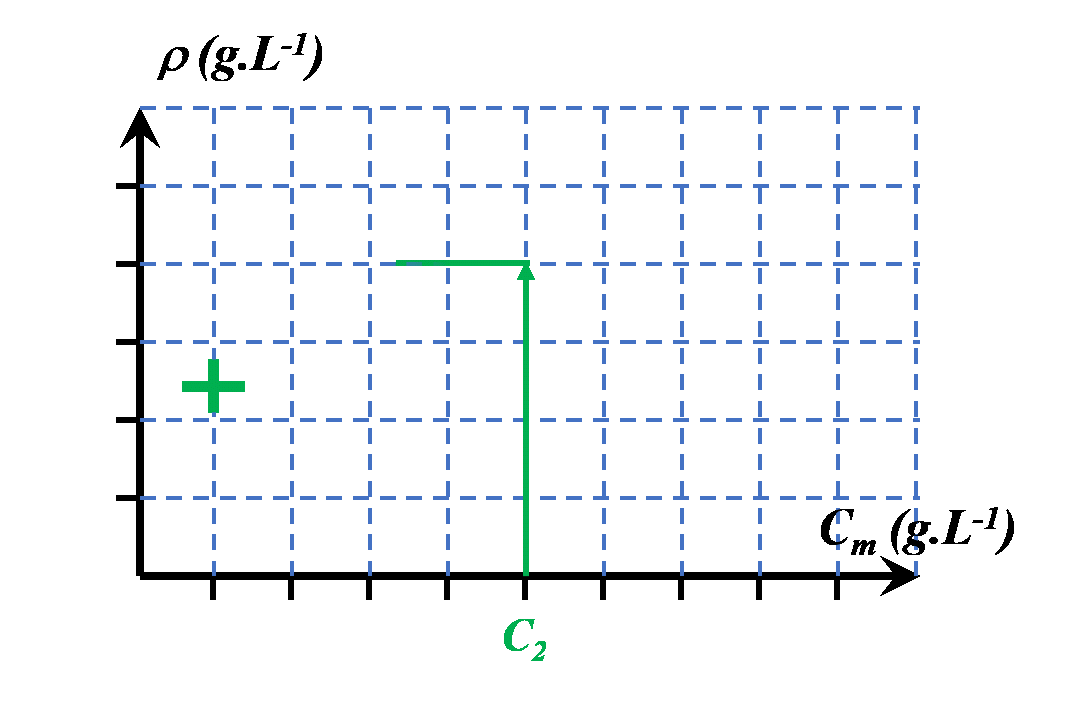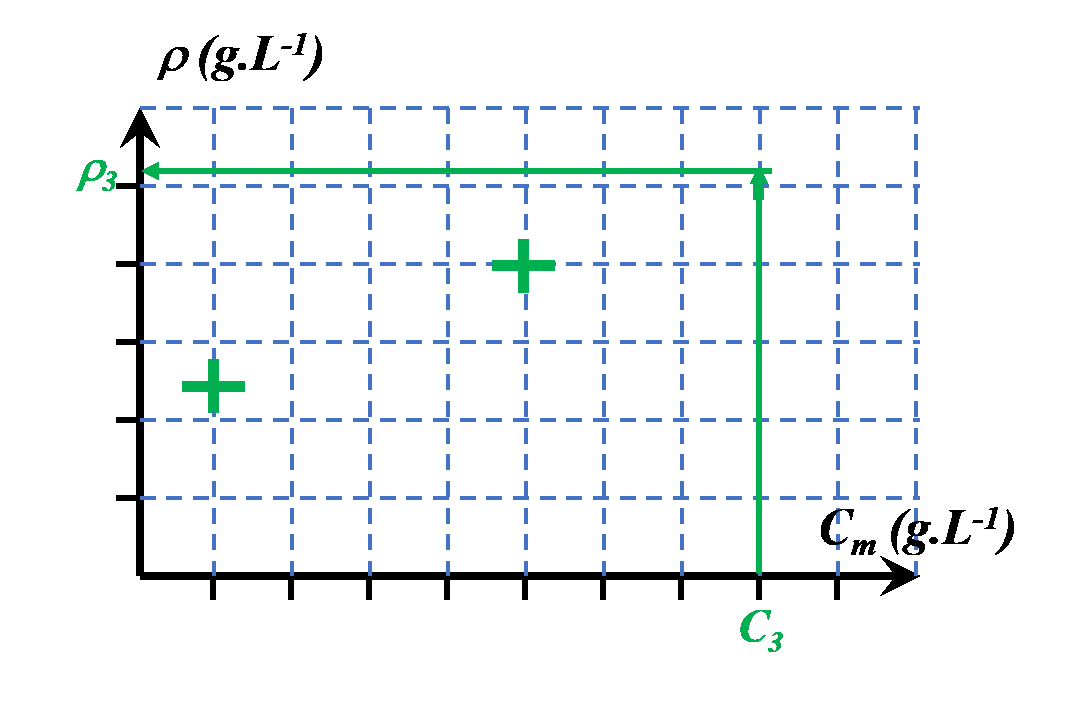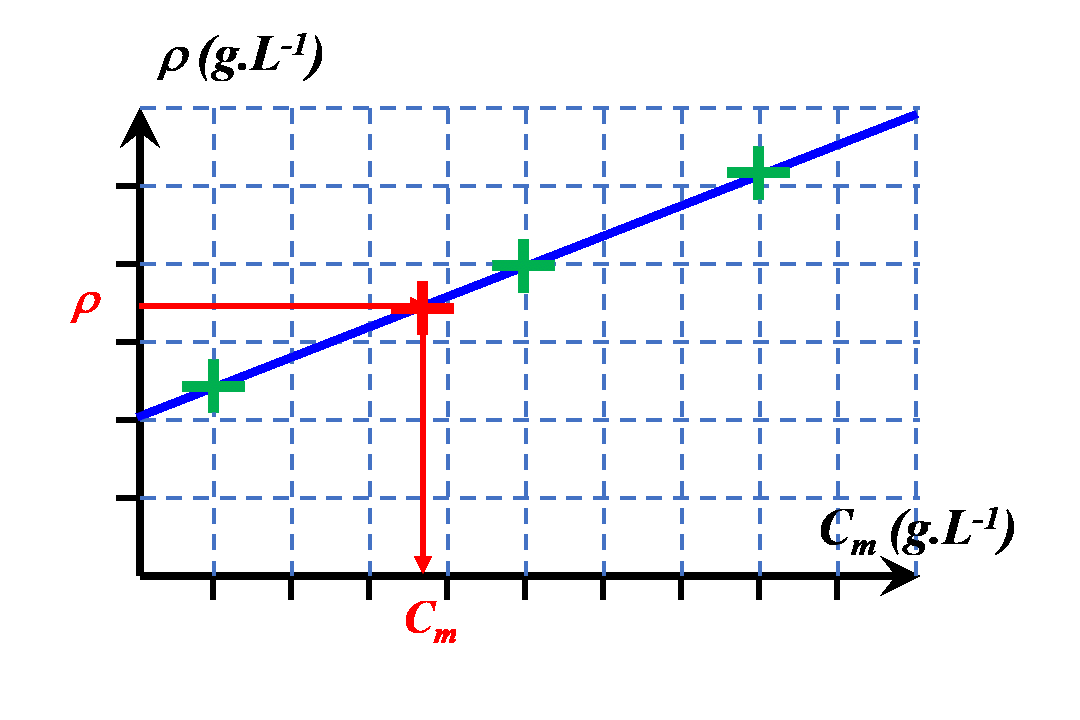 |
$\bullet$ On choisira une autre grandeur en lien avec les propriétés physiques de la solution. $\bullet$ On la mesurera pour différentes solutions de concentrations connues. $\bullet$ On la mesurera pour la solution de concentration inconnue. $\bullet$ On pourra ainsi déterminer la valeur de sa concentration, graphiquement ou à l'aide d'une modélisation mathématique pertinente. |
Ajouter un commentaire



