Les éléments chimiques
ACTIVITES
A1. Les éléments chimiques dans les étoiles.
Les astrophysiciens identifient les éléments chimiques présents dans les étoiles en analysant leurs spectres lumineux.
Objectif : Comment peut-on déterminer la composition des étoiles à partir de leurs spectres lumineux ?
|
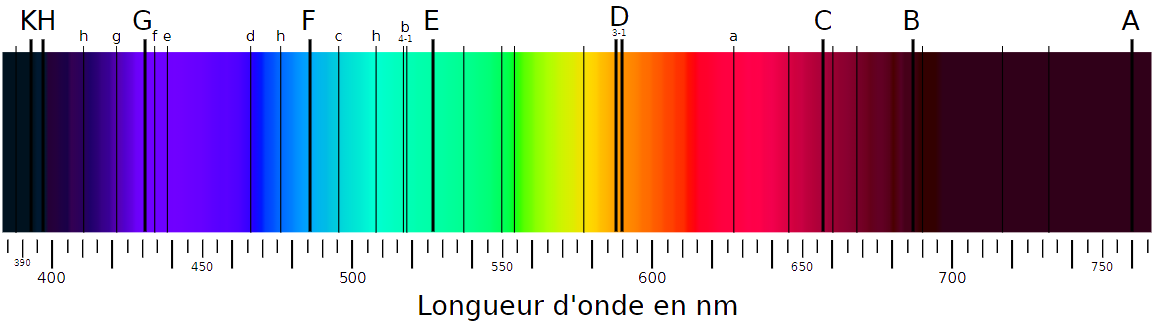
Doc 1 : Spectre du Soleil Le spectre d’une étoile est la superposition d’un spectre d’émission (d’origine thermique - fond coloré - et de raies d’absorption (spectre d’absorption, raies noires). La longueur d’onde des raies permet d’identifier les éléments chimiques présents dans l’étoile. Dans le cas du Soleil elles sont appelées « raies de Fraunhofer » du nom du physicien allemand qui les a observées au XIXe siècle. Les raies A à H ont été identifiées en 1814. |
|
• L’atome d’hydrogène est caractérisé par plusieurs raies lumineuses. Une des raies a une longueur d’onde de 656 nm. Peut-on identifier cette raie sur le spectre ?
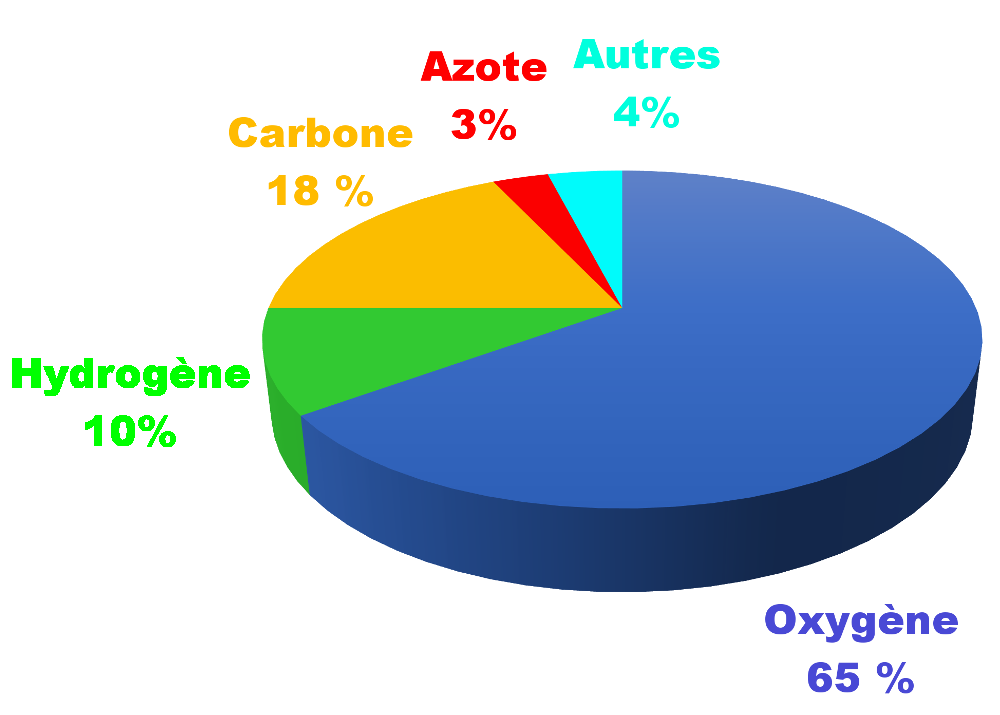
• Tracer un diagramme circulaire donnant la composition chimique en pourcentage massique du Soleil. (Utiliser un tableur ou à la main)
• Expliquer comment identifier les éléments chimiques présents dans une étoile.
A2 La radioactivité, un phénomène naturel.
La radioactivité a été découverte par hasard par Henri Becquerel en 1896. L’étude de la désintégration du carbone 14 permet de comprendre ce phénomène.
Qu’est-ce que la radioactivité ?
|
|
|
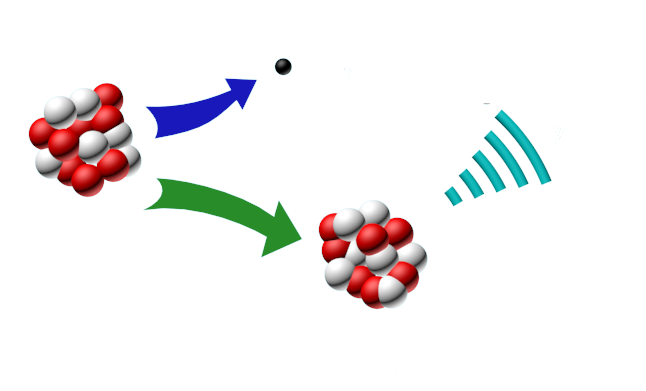
Doc3 : La désintégration du carbone 14. Le carbone14 (Z = 6) est un noyau radioactif instable, qui se désintègre en libérant un électron et en se transformant en un autre noyau, l'azote 14 (Z = 7). Dans le noyau, un neutron se transforme en proton en éjectant un électron. Le noyau ainsi formé se désexcite ensuite en émettant un roi à rayonnement gamma (γ). |
|
Définitions : Fluorescence : propriété d'un corps qui, après avoir été éclairé, émet de la lumière. Noyau radioactif : noyau instable qui se désintègre inéluctablement à un instant qui n'est pas prévisible. |
• Quelles observations de Becquerel lui ont permis d’affirmer que la radioactivité est un phénomène naturel ?
• Combien de temps faut-il pour que la population en carbone 14 d’un échantillon soit divisée par 2 ? Et par 4 ?
• Donner la composition du noyau de carbone 14 (Z=6).
• Identifiez la modification qui a eu lieu dans le noyau de l’atome de carbone 14 au cours de sa désintégration et écrivez l’équation de la désintégration.
• Synthèse : expliquer le phénomène de radioactivité à travers l’exemple du carbone 14.
A3 L'origine des éléments chimiques.
Il existe près d’une centaine d’éléments chimiques dans l’Univers. Pourtant, dans une étoile, on trouve principalement de l’hydrogène et de l’hélium. Les éléments chimiques sont formés dans les étoiles au cours d’un ensemble de processus appelé "nucléosynthèse".
Comment les éléments chimiques sont-ils formés ?
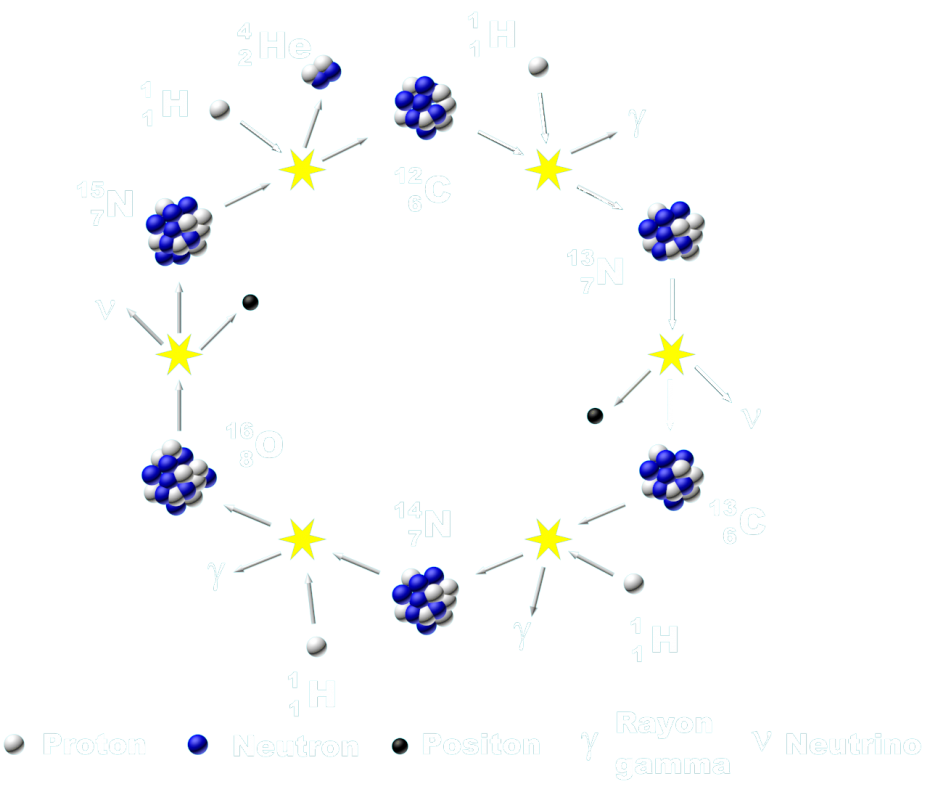
Groupe 1 : Le Soleil, siège de réactions nucléaires de fusion.
|
|
• Décrire les principales étapes de la vie d’une étoile.
•Écrire les équations du cycle CNO.
Groupe 2 : Les réactions nucléaires.
|
Doc 5 : La radioactivité naturelle. Certains noyaux sont instables : on dit qu’ils sont radioactifs. La radioactivité est un phénomène naturel, qui se traduit par la "transmutation" d’un élément chimique instable, le "noyau père", en un autre, le "noyau fils" de façon inéluctable, aléatoire, spontanée et indépendante des conditions extérieures. Il existe plusieurs types de désintégration.· La désintégration α? concerne les noyaux "trop gros", qui contiennent trop de neutrons et de protons pour que les interactions qui maintiennent la cohésion du noyau soient suffisantes. Ils se désintègrent en libérant une particule a (un noyau d’hélium 4). · La désintégration β - concerne les noyaux qui contiennent trop de neutrons. Un neutron va donc transmuter (se transformer) en un proton, en libérant un électron. · La désintégration β + concerne les noyaux qui contiennent trop de protons. Un proton va donc transmuter en un neutron, en libérant un positon (ou positron), antiparticule de l’électron |
|
|
• Identifiez les particules émises lors des trois formes de désintégration présentées.
• Donner les caractéristiques des réactions de fusion et fission.
• Expliquez à l'oral : la différence entre désintégration naturelle et réaction provoquée.
• Expliquez à l'oral : pourquoi le phosphore 30 est un élément qui n’existe pas dans la nature.
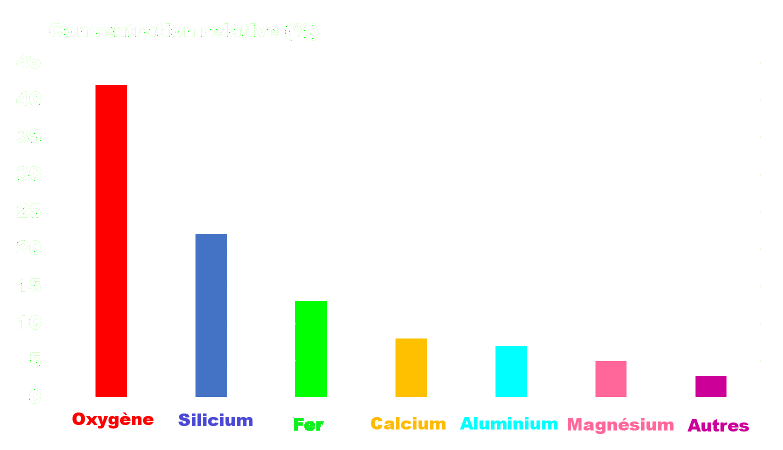
Groupe 3 : Abondance des éléments chimiques dans l'Univers.
|
Doc 8 : Les éléments chimiques dans l'Univers. |
|
|
• Déterminez les valeurs de l’abondance relative des éléments plus abondants que le silicium dans l’Univers, selon la taille de leurs noyaux ?
• Avec un tableur réaliser les diagrammes circulaires de l’abondance des éléments dans la croûte terrestre et le sol lunaire.
• Comparez l’abondance des éléments chimiques dans les différents domaines.
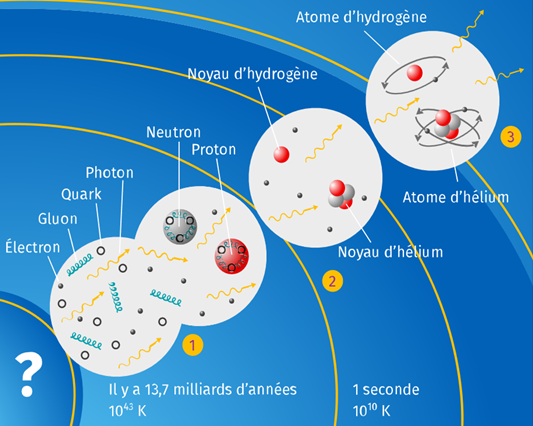
Groupe 4 : Du Big Bang au développement de la vie.
|
Doc 12 : Histoire simplifiée de l'Univers. Nul ne sait ce qui existait avant ou s’il existait un avant, mais le Big Bang est un modèle physique qui permet de décrire l’évolution de l’Univers depuis 13,7 milliards d’années.Au départ, l’Univers devait être un mélange de quarks, d’électrons, de photons et de gluons. Ce mélange est appelé « soupe primordiale ». Cet état condensé aurait permis la formation des premiers protons et neutrons. Dans les quelques minutes qui ont suivi, la nucléosynthèse primordiale aurait eu lieu : les atomes d’hydrogène, d’hélium et de lithium se seraient formés. L'Univers aurait ensuite diffusé un rayonnement, le fond diffus cosmologique, que l’on capte encore de nos jours, et qui constitue un des éléments essentiels en faveur du modèle du Big Bang. Les premières galaxies, regroupant des milliards d’étoiles, auraient été formées 700 millions d’années plus tard. Notre planète, la Terre, se serait formée il y a 4,5 milliards d’années, peu de temps après notre Soleil. Il aurait fallu près d’un milliard d’années pour que les premières bactéries, à l’origine de la vie, y fassent leur apparition. |
|
|
|
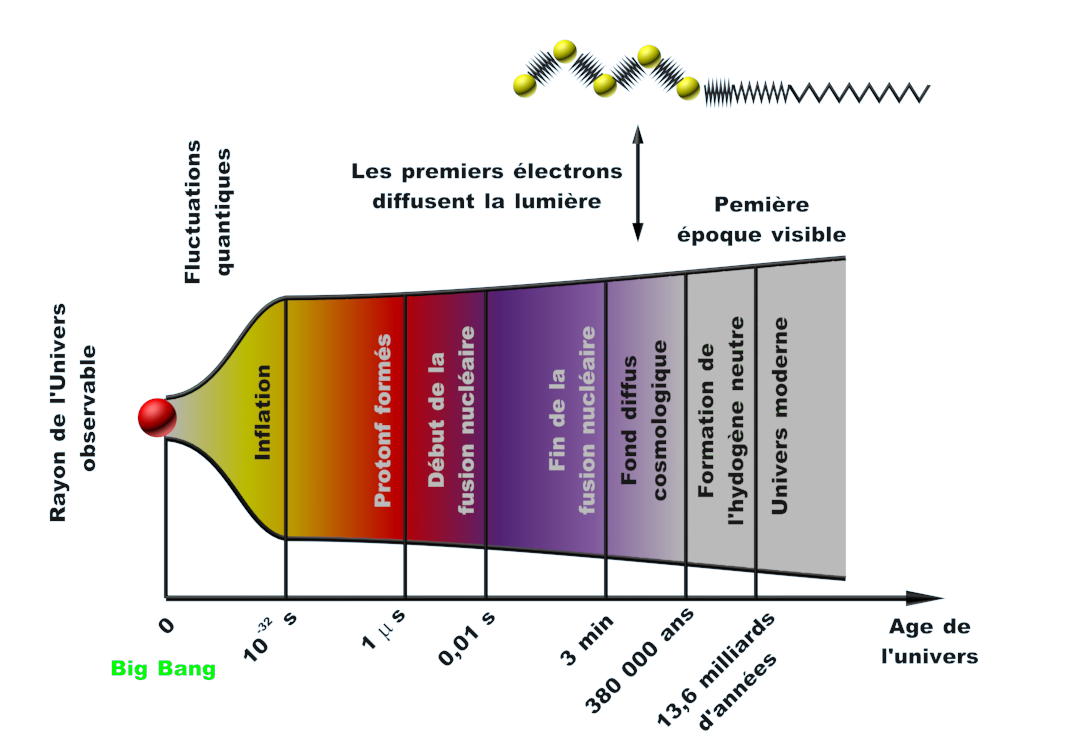
Doc 15 : Le schéma simplifié du Big Bang. |
• Réaliser une frise chronologique présentant les différentes étapes du Big Bang à l’apparition de la vie.
• Expliquer les critères nécessaires à l’apparition de la vie.
Commentaires
-

- 1. Ano Le 24/09/2021
Bonjour, c'est dommage qu'il n'y ai pas de correction en disponibilité. Je cherche des exercices pour m’entraîner en vu de mon contrôlé cependant sans correction je ne peux pas faire grand chose.-

- bob_coyoteLe 02/10/2021
Bonjour. Je veux bien t'aider, mais pose-moi des questions... On peut se donner RDV demain. Cordialement. Greg
Ajouter un commentaire