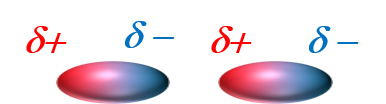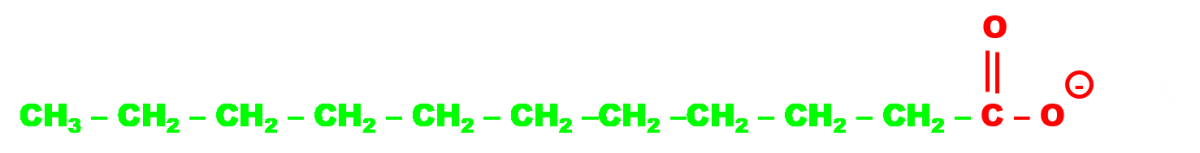Cohésion de la matière
ACTIVITES
A1. Expliquer la cohésion de la matière.
L'oxygène et le soufre font partie de la même colonne de la classification périodique et forment des composés analogiques : l'eau et le sulfure d'hydrogène. La température de fusion de l'eau H2O est de 0°C alors que celle du sulfure d'hydrogène H2S est de -85,5°C.
Question : Comment expliquer la différence de température de fusion de ces deux composés ?
|
Doc1. Quelques données à la pression atmosphérique.
|
|
• Indiquer les espèces moléculaires et les composés ioniques du Doc 1.
• Déterminer à partir des valeurs des électronégativités, quelles sont les molécules polaires et indiquer leurs charges partielles.
• Associer à chaque solide du Doc 1, le(s) type(s) d’interaction(s) responsable(s) de leur cohésion.
• Certaines molécules font intervenir plusieurs interactions : leurs énergies s’additionnent. Classer les solides du Doc 1 selon l’intensité des interactions.
• Expliquer le décalage de température de fusion entre l’eau et le sulfure d’hydrogène.
A2 Préparer une solution ionique.
Pourquoi le sel se dissout-il dans l'eau et pas dans le cyclohexane ?
|
|
A20. Introduction.
• Rappeler les répartitions électroniques et les représentations de Lewis des atomes de carbone, d'hydrogène, d'oxygène, de sodium et de chlore.
• En déduire aussi les représentations de Lewis des ions sodium Na+ et chlorure Cl- .
A21. Dans l'eau.
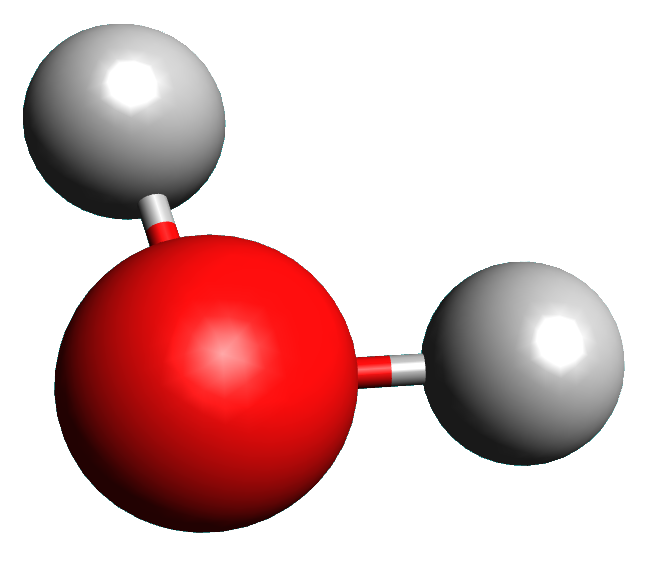
• Donner la géométrie de la molécule d'eau ainsi que son éventuelle polarité.
• Expliquer en quoi les molécules d’eau peuvent exercer une force électrostatique sur un ion et justifier leur orientation à proximité des ions.
• Calculer et comparer les valeurs des forces électrostatiques qui s’exercent sur un ion sodium et un ion chlorure séparés d’une distance dAB = 2,0 nm lorsque ces ions sont placés dans l’air, dans l’eau, dans l’éthanol.
• Expliquer pourquoi la dispersion est plus efficace dans l’eau que dans l’éthanol.
• Expliquer comment l’eau parvient à dissocier le cristal et à solvater les ions libérés. Expliquer la dispersion des ions.
A22. Dans le cyclohexane.
• Donner la représentation de Lewis du cyclohexane et son éventuelle polarité (utiliser le logiciel Avogadro).
• Comparer les valeurs des forces électrostatiques qui s’exercent entre un ion sodium et un ion chlorure séparés d’une distance dAB = 2,0 nm lorsque ces ions sont placés dans l'eau et le cyclohexane.
• Expliquer pourquoi le sel est soluble dans l’eau mais pas le cyclohexane.
A23. Conclusion.
Si un corps est polaire, il se dissout plus facilement dans un solvant………………….
Si un corps est apolaire, il se dissout plus facilement dans un solvant ………………..
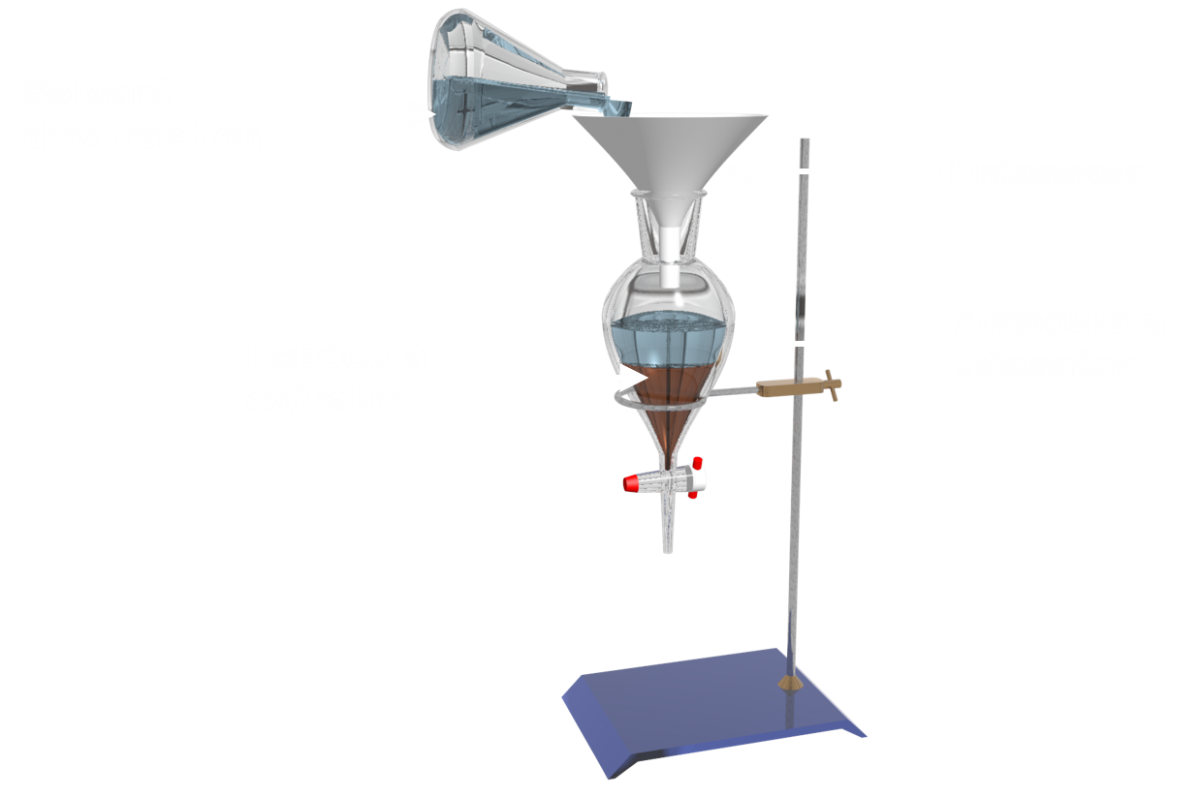
A3 Extraction.
Comment trier les déchets ?
|
|
|
Doc 3. Le cyclohexane. |
• Le diiode est-il une molécule polaire ?
• Le sulfate de cuivre en solution possède-t-il des propriétés polaires une fois dissout dans l'eau ?
• Le cyclohexane est-il polaire ?
• Proposer un protocole pour trier les produits de la solution du doc 1.
• Le diiode est aussi soluble dans l'huile d'arachide. Affiner le protocole précédent afin d'être moins nuisible à l'environnement.
A4 Propriété des savons.
Les savons contiennent des liaisons à longue chaine carbonée. Leurs propriétés lavantes sont dues à la structure des ces ions en interaction avec le milieu qui les contient.
Quels types d'interactions mettent en jeu les ions carboxylates lors de l'utilisation d'un savon ?
|
Doc1. Constitutions des savons.
Qui possède un groupe hydrophile (du grec hydro : eau et philos : ami) et un groupe lipophile (du grec lipos : graisse) |
|
|
• On dispose d’une solution de chlorure de sodium $\left (Na^{+}_{(aq)};Cl^{-}_{(aq)} \right ) $eau salée.
• D’une solution de chlorure de calcium $\left (Ca^{2+}_{(aq)};2Cl^{-}_{(aq)} \right ) $ eau dure.
Élaborer et mettre en œuvre un protocole mettant en évidence les effets d’une eau dure ou d’une eau salée sur les propriétés lavantes des savons.
• Proposer une explication du caractère hydrophile de l’ion carboxylate.
• Justifier l’action d’une solution de chlorure de sodium ou de calcium sur les propriétés lavantes du savon.
•Quels types d’interactions les ions carboxylate mettent-ils en jeu
EXERCICES : P 90 à 103.
8, 9, 11, 13, 14, 15, 18, 20, 23, 25, 28, 29, 36.
COURS
C1. Cohésion d'un solide.
C11. Solide ionique.
|
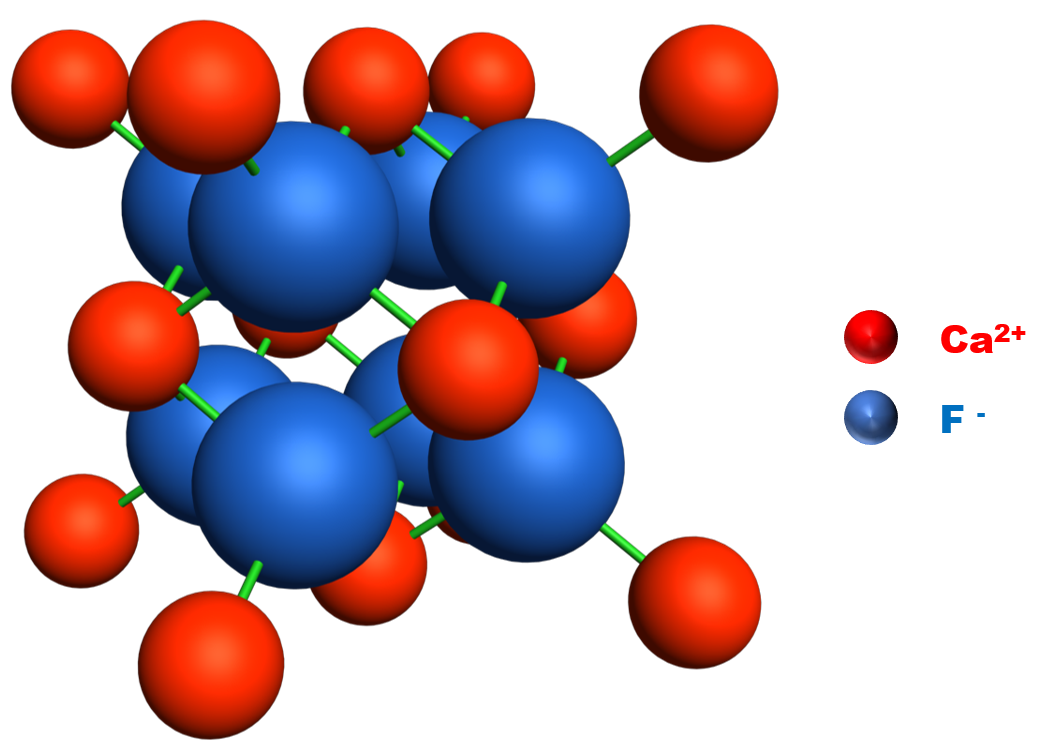
Structure du fluorure de calcium |
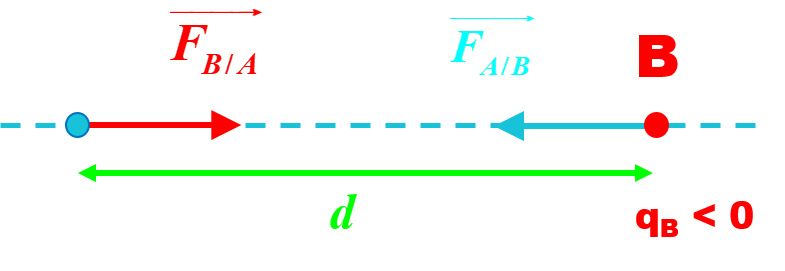
• Un solide ionique est constitué de cations et d'anions organisés régulièrement dans l'espace. • Ces ions s'attirent mutuellement selon la force électrostatique : $F_{A/B} \ = \ F_{B/A} \ = \ 9,0.10^{9} \times \dfrac{|q_A| \times |q_B|}{d^2}$ |
C12. Solide moléculaire.
Les molécules sont électriquement neutres, régulièrement disposées dans l'espace.
C12a. Interaction de Van Der Waals.
Ce sont des interactions électrostatiques attractives présentes entre les molécules.
|
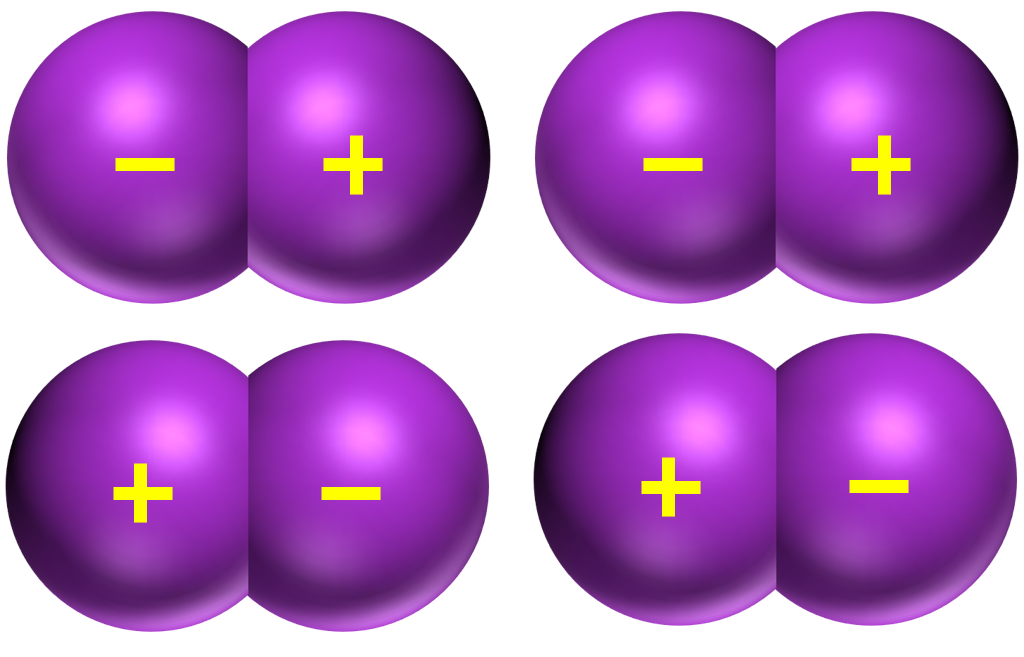
Cas des molécules polaires. Elles sont constituées d'atomes ayant un grand écart d'électronégativité. Cet écart fait apparaître une charge partielle sur chaque atome. Cette charge partielle implique une interaction électrostatique entre les molécules. Interaction entre les molécules de chlorure d'hydrogène |
Cas des molécules apolaires. Elles sont constituées d'atomes n'ayant pas ou peu d'écart d'électronégativité. Cependant, le mouvement désordonné des électrons fait apparaître des charges partielles qui impliquent alors l'attraction simultanée des molécules. |
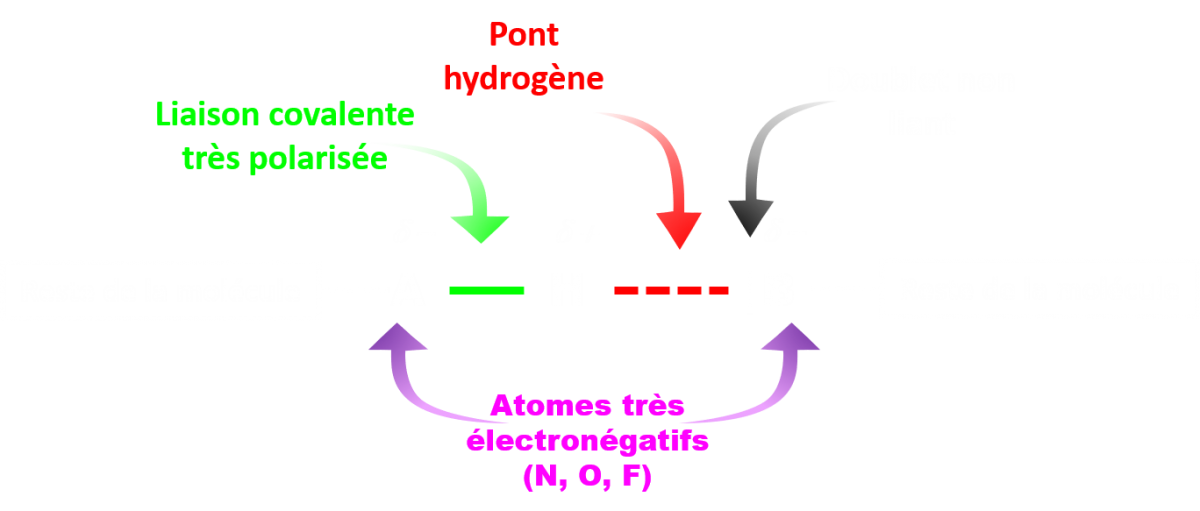
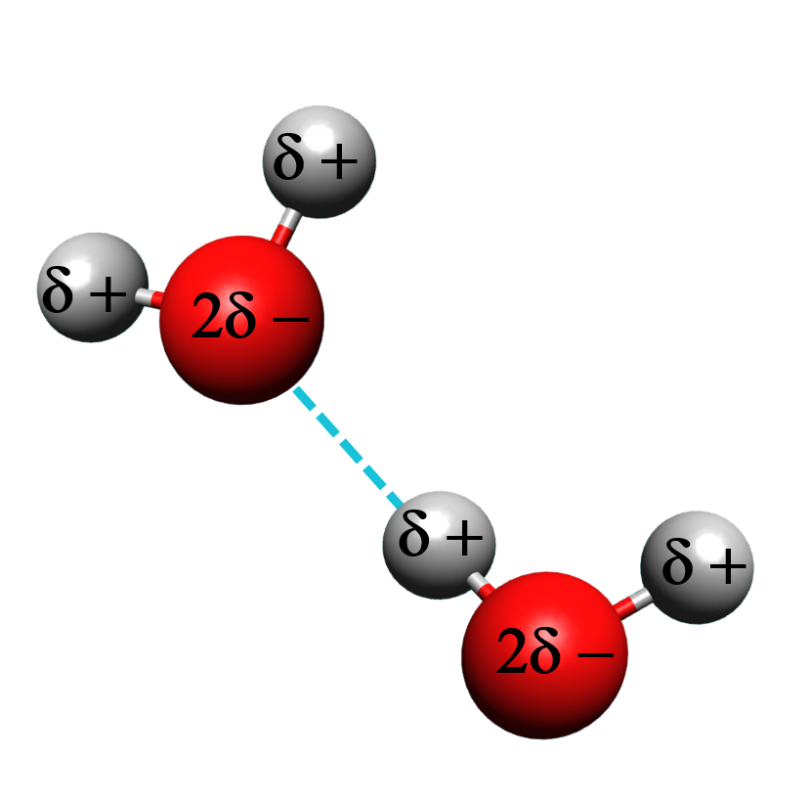
C12b. Les liaisons hydrogène.
| C'est une interaction attractive établie entre un atome d'hydrogène lié à un atome très électronégatif et l'atome très électronégatif d'une autre molécule porteur d'un doublet non liant. |
C'est ce type de liaison qui assure la cohésion de l'eau |
C2. Solubilité d'une espèce chimique.
C21. Selon le solvant.
Un solvant peut être constitué de molécules polaires (eau, éthanol…) on parle alors de SOLVANT POLAIRE, ou de molécules apolaires (cyclohexane), on parle dans ce cas de SOLVANT APOLAIRE.
|
solvants polaires
|
solvant apolaire cyclohexane (C6H12) |
C22. Solubilité dans le solvant.
La solubilité d'un soluté dans un solvant donné sera d'autant plus importante que les interactions entre le solvant et le soluté seront importantes.
- Les solides ioniques sont solubles dans les solvants polaires (interactions électrostatiques entre le solvant et le soluté).
- Les solutés moléculaires polaires sont solubles dans les solvants polaires pour la même raison.
- Inversement, les solutés moléculaires apolaires sont solubles dans les solvants apolaires.
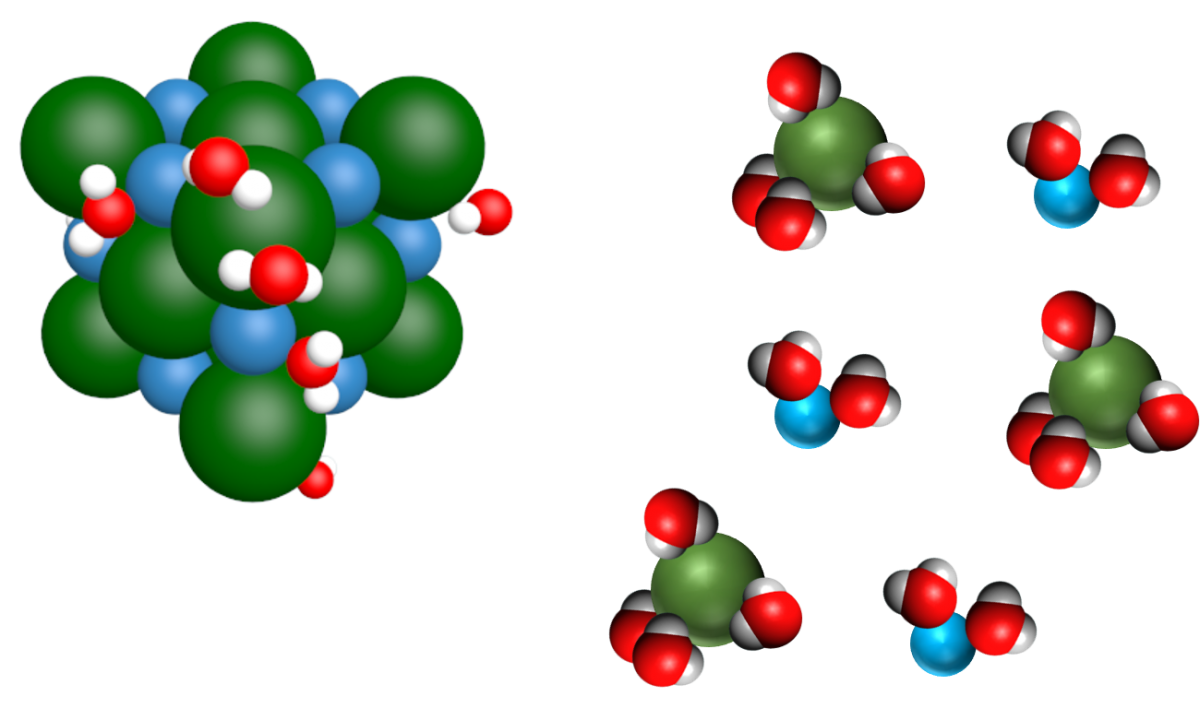
C23. Dissolution d'un solide ionique dans l'eau.
|
La dissolution s'effectue en trois étapes :
|
 |
Rappel.
|
La dissolution d'un solide ionique $A_xB_{y(s)}$ dans l'eau est modélisée par l'équation de dissolution : $ A_xB_{y(s)} \xrightarrow { \ \ eau \ \ } x \ A^{y+}_{(aq)} + \ y \ B^{x-}_{(aq)} $ Cette réaction respecte la conservation de la matière et de la charge. Les concentrations en quantité de matière sont données par les relations :
$\left [ A^{y+}_{(aq)} \right ] = \dfrac {n \left ( A^{y+}_{(aq)} \right )}{V} = \dfrac { x \times n (A_xB_y)}{V} $ et $\left [ B^{x-}_{(aq)} \right ] = \dfrac {n \left ( B^{x-}_{(aq)} \right )}{V} = \dfrac { y \times n (A_xB_y)}{V} $
|
Commentaires
-

- 1. Greg Le 22/04/2021
Bonjour.
Il s'agit d'activités proposées à mes classes pendant les séances.
Tu comprendras que je veuille bien répondre à des questions, mais pas fournir des corrigés... au départ, il s'agit d'un travail à effectuer par des élèves.
Cordialement. -

- 2. Thomas Le 20/04/2021
Pourrait-on avoir la correction des questions s’il vous plaît -

- 3. Greg Le 09/04/2021
Tu dois pouvoir y accéder directement... clic-droit, enregistrer...
Merci de préciser quand tu l'utiliseras de préciser d'où elle vient...
Sinon... ben... tant pis ou tant mieux.. pour moi.

-

- 4. Greg Le 02/04/2021
Bonjour.
De quelles vidéos parles-tu ?
Généralement ce sont des gif que je crée.
(Activité2, doc3... je n'en vous pas d'autres).
Dis-moi.
Greg -

- 5. pin Le 20/03/2021
Bonjour, pourrais tu m'envoyer s'il te plait la video qui explique les 3 étapes de la dissolution de NaCl dans l'eau
Cordialement
Bruno PIN
Ajouter un commentaire