Composition d'un système chimique
ACTIVITES
A1. Contrôle de la qualité de l'eau du robinet.
Le contrôle qualité de l’eau du robinet en France est une préoccupation majeure sur le plan de la santé. Un très grand nombre de polluants, dont des résidus de pesticides ou de médicaments sont analysés.
Quelle quantité maximale de polluant peut-on ingérer ?
• À l’aide du tableau, calculer la masse d’une mole d’atomes d’oxygène puis de chlore.
• Comparer les résultats obtenus avec ceux du tableau périodique.
• Déterminer la masse d’une mole d’ions perchlorate $ClO^{-}_{4} $.
• Déterminer la masse d’une mole de chacun des polluants cités dans les données.
• Quelle masse de NMOR peut-on consommer sans risque dans une vie ?
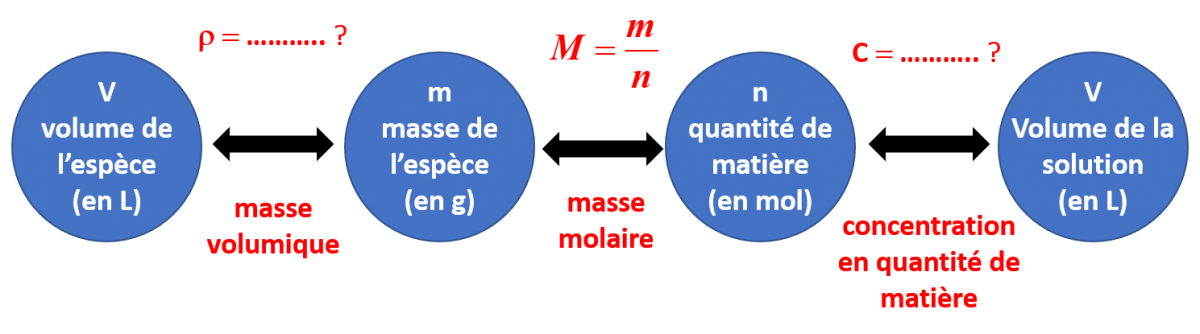
• Proposer une expression littérale permettant de relier la masse m d’un échantillon à la quantité de matière n qu’il contient et à sa masse molaire M c’est à dire la masse d’une mole d’entités dont est constitué cet échantillon.
• Déterminer quel polluant doit être consommé en quantité minimale.
A2. Lâcher de ballons.
| Pour faciliter leur stockage ou leur transport, les gaz sont en général comprimés. Par exemple, la bouteille ci-contre de volume interne V =14 L permet de stocker de l’hélium sous une pression de 18 bar. Le gaz peut être utiliser pour gonfler des ballons. |  |
Combien de ballons peuvent être gonflés avec cette bouteille ?
|
|
Données :
|
•Calculer la masse molaire M(formule brute) de chacune des espèces des gaz étudiés.
• En déduire la quantité de matière n de gaz contenu dans chacune des bouteilles.
• Pour chaque espèce, calculer le volume molaire Vm .
• Proposer une expression littérale permettant de relier le volume V d’un échantillon de gaz à la quantité de matière n qu’il contient.
• Préciser si, pour une pression et une température fixées, le volume molaire dépend de la nature du gaz considéré.
• Identifier à l’aide des données, de quels paramètres dépend le volume molaire d’un gaz.
• Déterminer la quantité d’hélium contenu dans la bouteille citée en introduction.
• En déduire le nombre de ballons, chacun de volume V = 4,0L, que l’on peut espérer gonfler (à la pression atmosphérique et à 20 °C) avec le gaz contenu dans cette bouteille.
A3. Prélever une quantité de matière.
Dans un recueil d’expériences chimiques, on trouve le protocole expérimental permettant d’obtenir un « liquide étonnant ». Pour le préparer il faut prélever des quantités de matières.
Objectif : Comment prélever une quantité de matière d’une espèce chimique ?
|
Doc1 : Un liquide étonnant.
|
|||||||||||||||||
|
Doc 2 : Des grandeurs en relation. |
|
Données : Masse volumique de l’eau : ρeau = 1,0 g.mL-1. Masses molaires atomiques : M(H) = 1,0 g.mol-1 ; M(O) = 16,0 g.mol-1. Masse molaire moléculaire : M(C6H8O6) = 176,0 g.mol-1 |
• Compléter le schéma du document 2.
• Déterminer la masse d’acide ascorbique, le volume d’eau distillée et le volume d’eau oxygénée à prélever pour obtenir le "liquide étonnant".
• Élaborer et mettre en œuvre un protocole permettant de préparer le "liquide étonnant".
• Pourquoi ce liquide est appelé "liquide étonnant" ?
• À partir des relations du schéma du document 2 complété, définir :
1) La masse molaire d'une espèce chimique :
2) La concentration en quantité de matière d’une espèce chimique.
A4. Dosage par photométrie.
|
Les confiseurs utilisent des colorants alimentaires afin que le produit associé reflète la couleur de la matière première, ou celle associée au produit. L'UE fixe pour tous les colorants alimentaires, des valeurs de dose journalière admissible (DJA).
|
 |
Quel est le colorant bleu présent dans un bonbon Schtroumpf ?
Objectif : Déterminer la quantité maximale de bonbons que l'on manger en une journée ?
|
Doc 1 : Spectres d'absorption de différents colorants.
|
|
|
|
|
$\bullet$ Faire fondre un bonbon dans 50 mL d'eau distillée.
$\bullet$ A l'aide du spectrophotomètre, identifier le colorant présent dans le bonbon.
$\bullet$ A partir de la solution $S_0$, compléter le tableau suivant, et faire valider par l'enseignant.
|
Solution |
$S_0$ |
$S_1$ |
$S_2$ |
$S_3$ |
$S_4$ |
$S_5$ |
|
Concentration ( $\times 10^{ \ -5} \ mol.L^{ \ -1}$) |
3,44 |
1,72 |
1,147 |
0,860 |
0,688 |
0,344 |
|
Volume de $S_0$ à prélever. |
$\bullet$ Une fois le tableau validé par l'enseignant, réaliser l'échelle de teinte.
$\bullet$ A quelle longueur d'onde se placer pour effectuer les mesures ? Justifier.
$\bullet$ Expliquer la couleur de la solution à l'aide du doc 5.
$\bullet$ Pour chacune des solutions, mesurer l'absorbance.
|
Solution |
$S_0$ |
$S_1$ |
$S_2$ |
$S_3$ |
$S_4$ |
$S_5$ |
|
Absorbance A |
|
|
|
|
|
|
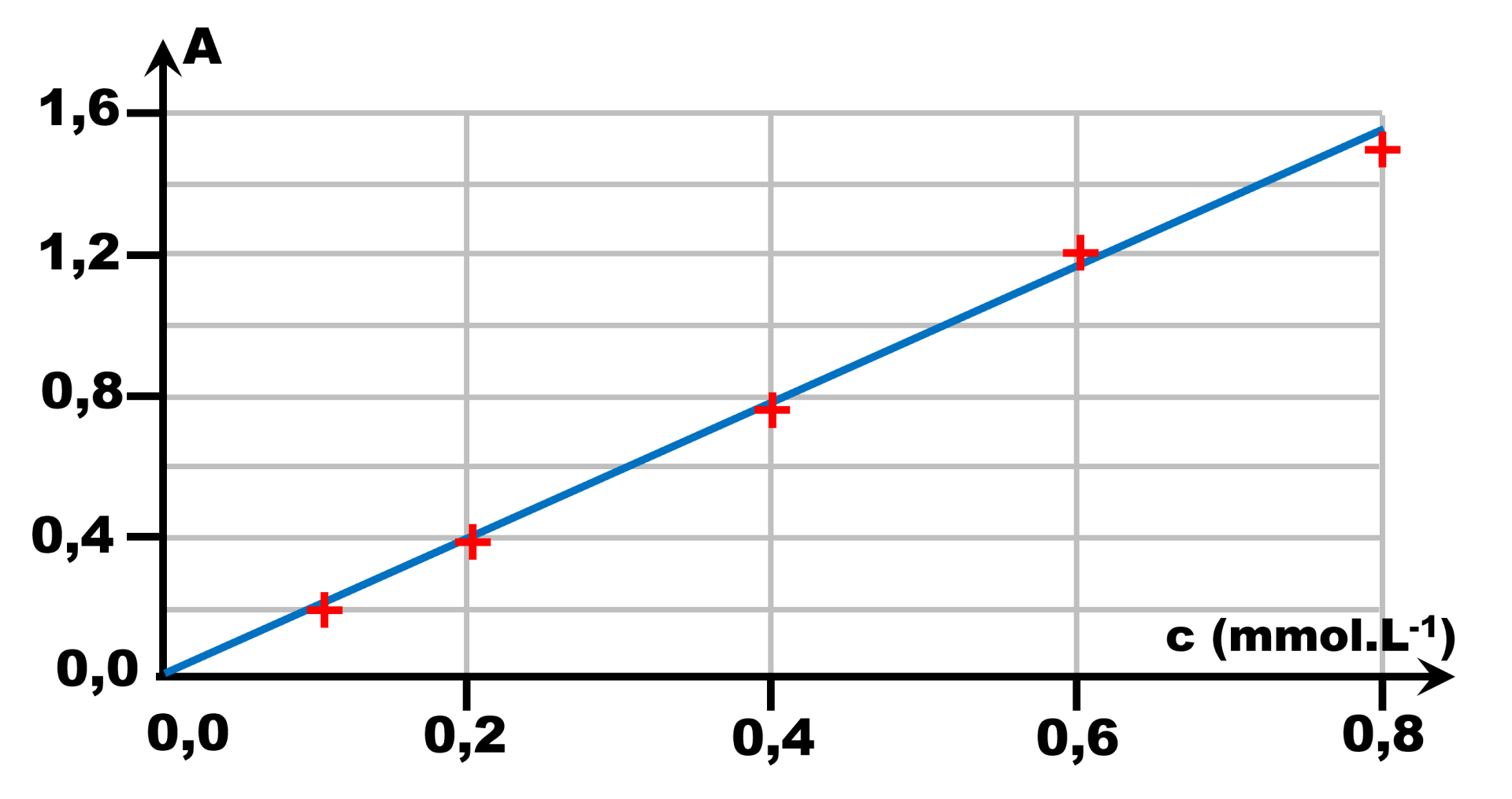
$\bullet$ Tracer le graphe représentant l'absorbance A en fonction de la concentration en colorant.
$\bullet$ La loi de Beer-Lambert stipule que l'absorbance A est proportionnelle à la concentration c. Cette loi est-elle vérifiée dans notre cas ? Si oui, tracer la fonction correspondante et donner son expression.
$\bullet$ Donner alors la valeur de la concentration en colorant dans la solution contenant le bonbon fondu.
$\bullet$ En déduire la masse de colorant correspondant. Conclure.
Exercices n° 8, 10, 11, 15, 16, 19, 23, 24, 25, 26, 35, 43, 44 P 29 à 37
COURS
C0. Les bases.
|
C01. Les bases.
La mole (mol) est l'unité de quantité de matière d'une entité élémentaire spécifique (atome, molécule, ion, électron).
La valeur de cette quantité est définie à partir du nombre d'Avogadro $\cal{N}_a = 6,02. 10^{23} $ :
Une mole de n'importe quelle entité élémentaire contient $\cal{N}_a$ entités élémentaires. |
Amedeo di Avogadro, physicien et chimiste Italien né à Turin le 9 août 1776, mort le 9 juillet 1856 |
Exemple :
- une mole d'atomes de fer contient 6,02.1023 atomes de fer.
- 6,02.1023 atomes de carbone correspondent à une mole d'atomes de carbone.
C02. Vocabulaire.
C01. Dosage.
Détermination d'une quantité de matière ou d'une concentration en utilisant différents appareils mesurant une grandeur physique.
C02. Dosage par étalonnage.
Détermination de la concentration (ou de la quantité de matière) d’une espèce chimique en solution en comparant une grandeur physique caractéristique de cette solution (par exemple l’absorbance) à celles de solutions étalons.
Il s’agit d’une méthode non destructive car l’espèce à doser demeure intacte.
C1. La masse molaire.
|
C11. La masse molaire atomique. La masse molaire atomique M d'un élément correspond à la masse d'une mole d'atomes de cet élément. Elle s'exprime en grammes par mole (g.mol-1). NB : dans la classification périodique des éléments, c'est la valeur indiquée en haut à droite.
Exemple : Dans le cas ci-contre, la masse molaire atomique de l'élément carbone de symbole C et de numéro atomique Z = 6 a pour valeur M(C) = 12,0 g.mol-1. |
 |
|
C11. La masse molaire moléculaire.
La masse molaire moléculaire d'une molécule correspond à la masse d'une mole de cette molécule. Elle s'exprime aussi en grammes par mole (g.mol-1).
NB : c'est la somme des masses molaires atomiques de tous les atomes qui constituent cette molécule.
Exemple : Pour la molécule d'éthanol de formule brute CH4O, la masse molaire moléculaire a pour valeur : M(CH4O) = 12,0 × 1 + 1,0 × 4 + 16,0 × 1 = 32,0 g.mol-1. |
|
|
C11. La masse molaire ionique.
La masse molaire ionique correspond à la masse d'une mole de cet ion. La masse des électrons étant très faible, elle correspond à la masse molaire atomique (s'il s'agit d'un ion monoatomique) ou à la masse molaire moléculaire (s'il s'agit d'un ion polyatomique) Elle s'exprime aussi en grammes par mole (g.mol-1).
Exemple :
M(Na+) = M(Na) = 23,0 g.mol-1.
$M(SO^{2-}_4) $ = 32,0 × 1 + 16,0 × 4 = 96,0 g.mol-1 |
|
C2. Déterminer la quantité de matière.
|
C21. Pour un solide. Pour un corps solide pur de masse m et de masse molaire M, la quantité de matière n est : $ n= \frac {m}{M}$ |
 |
|
C22. Pour un gaz.
|
Pour un corps gazeux pur de volume V, la quantité de matière n est : $ n= \frac {V}{V_m}$
Vm représente le volume molaire gazeux (24 L.mol-1). |
||||
|
C23. Pour un liquide.
Pour un corps liquide pur de masse volumique r de volume V, de masse molaire M, la quantité de matière n est : $ n= \frac {\rho \times V }{M}$
|
 |
|
C24. Pour une solution aqueuse.
C24a. Pour un corps en solution aqueuse à la concentration molaire c (en mol.L-1), la quantité de matière est : $ n= C \times V$
Le volume V est exprimé en litre (L)
C24b. Pour un corps en solution aqueuse à la concentration massique cm (en g.L-1), la quantité de matière est : $ n= \frac {C_m \times V }{M}$
Le volume V est exprimé en litre (L) |
C3. Dosage par étalonnage colorimétrique.
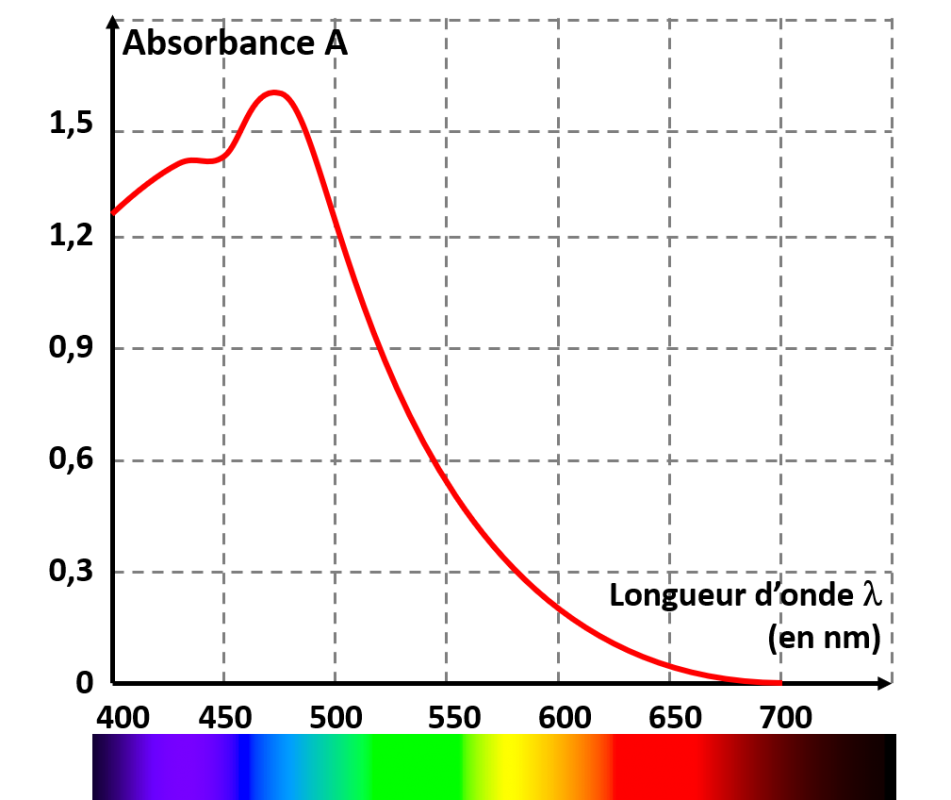
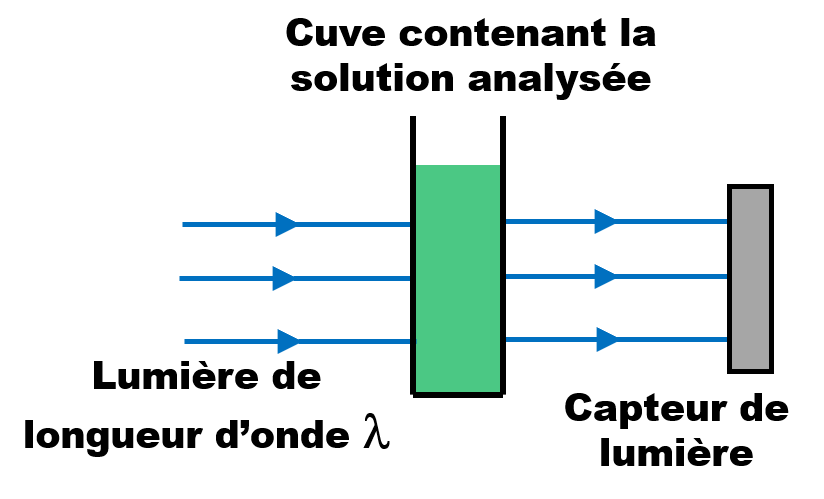
C31. Absorbance et spectre d'absorption.
|
• Le spectre d'absorption d'une espèce chimique en solution est une courbe obtenue à l'aide d'un spectrophotomètre. •Cette courbe représente l'absorbance A de la solution en fonction de la longueur d'onde λ. |
 |
|
L'absorbance représente la capacité d'une solution à absorber la lumière à une longueur d'onde donnée.
|
 |
C32. Couleur d'une espèce en solution.
|
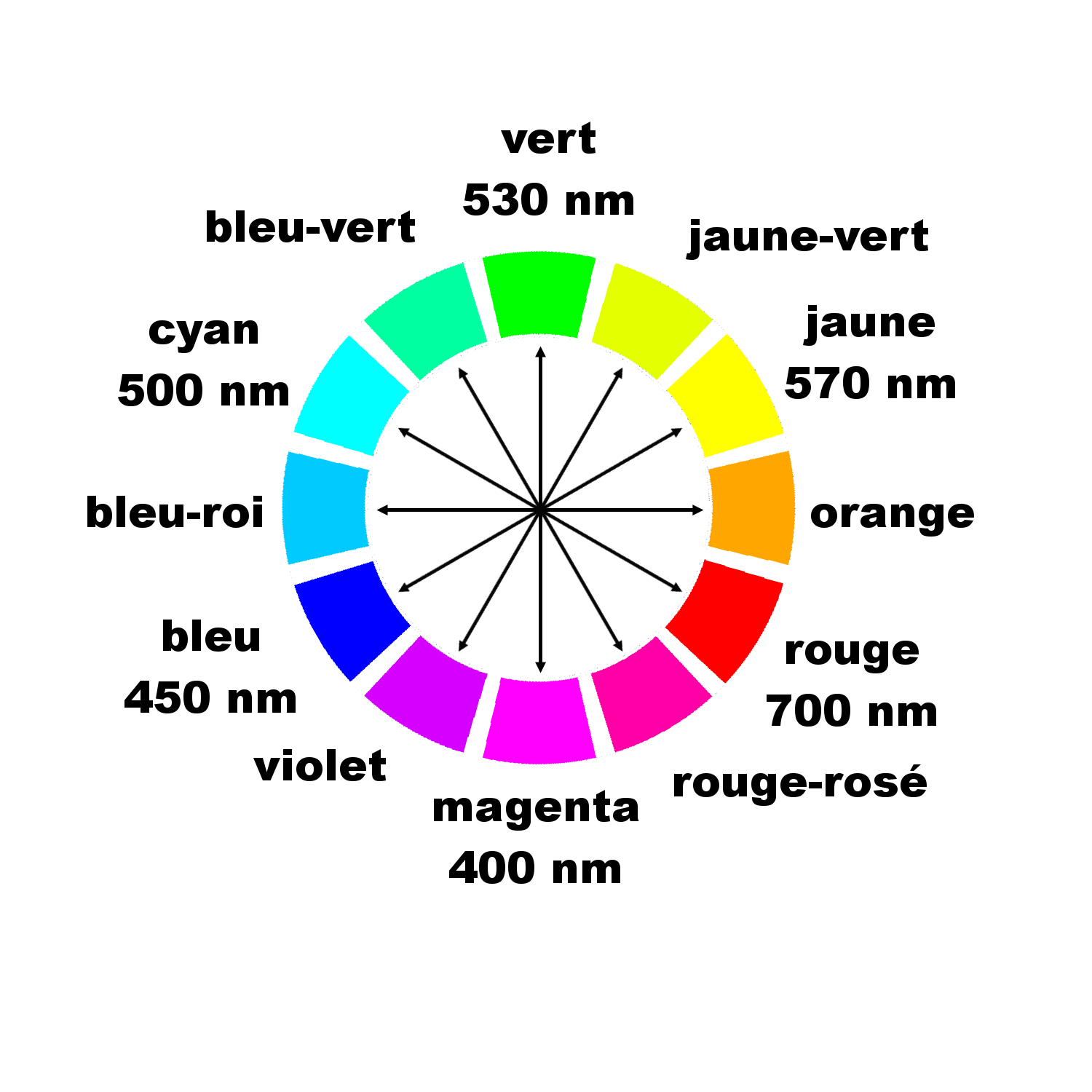
La couleur d'une espèce chimique en solution est liée à son spectre : c'est la couleur d'une lumière obtenue par synthèse soustractive. La couleur observée est la couleur complémentaire de la couleur absorbée.
Exemple : Le spectre d'absorption d'une solution de sulfate de cuivre montre que cette solution absorbe au maximum dans le rouge. Sa couleur est cyan. |
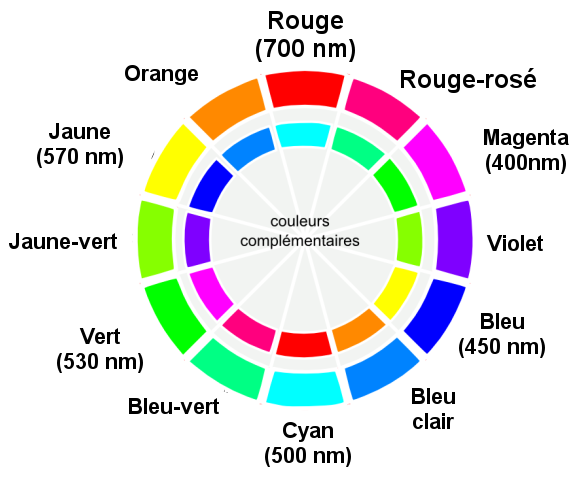 |
C33. Loi de Beer-Lambert.
L'absorbance A d'une solution, contenant une seule substance à la longueur d'onde λ est proportionnelle à la concentration c de cette substance et à la longueur l de la solution traversée :
|
A : absorbance sans unité ε : coefficient d'absorption en L.mol-1.cm-1 l : largeur de la cuve en cm c : concentration molaire en mol.L-1 |
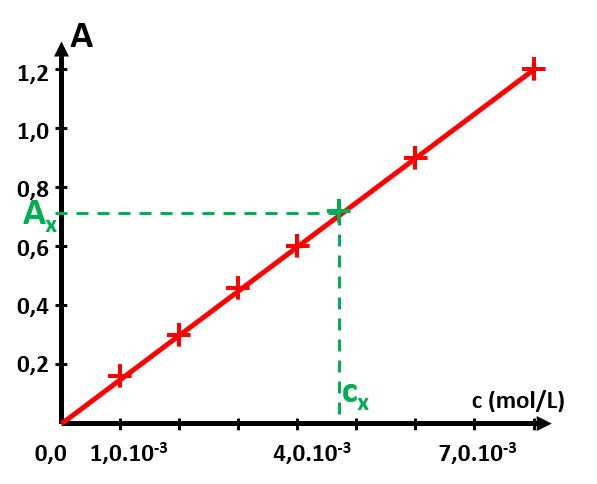
C34. Principe d'un dosage par étalonnage.
|
1. Réaliser une échelle de teintes de concentrations connues de solutions du même soluté que la solution à étudier.
2. Pour chaque concentration c des solutions de l'échelle de teintes, mesurer l'absorbance A.
3. Tracer A en fonction de c. C'est une droite linéaire d'étalonnage si la loi de Beer-Lambert est vérifiée.
4. Mesurer l'absorbance Ax de la solution à analyser et utiliser la courbe précédente pour déterminer sa concentration cx. |
échelle de teintes droite d'étalonnage |
Ajouter un commentaire