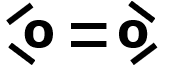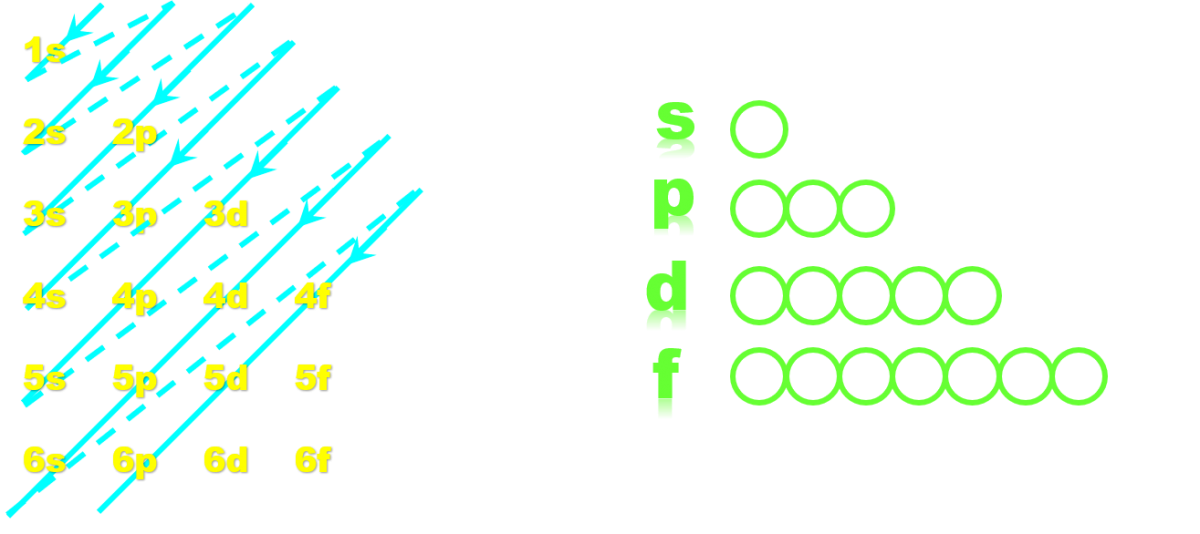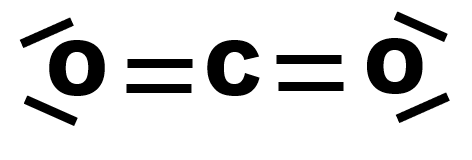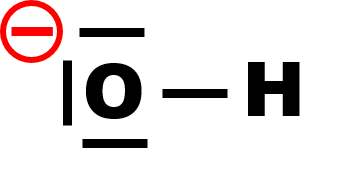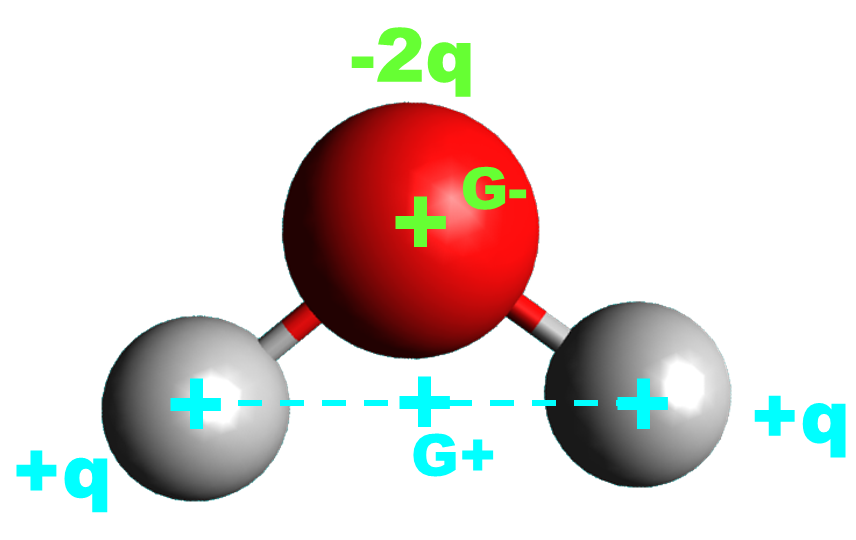Polarité et Structure
ACTIVITES
A1. Construire un schéma de Lewis.
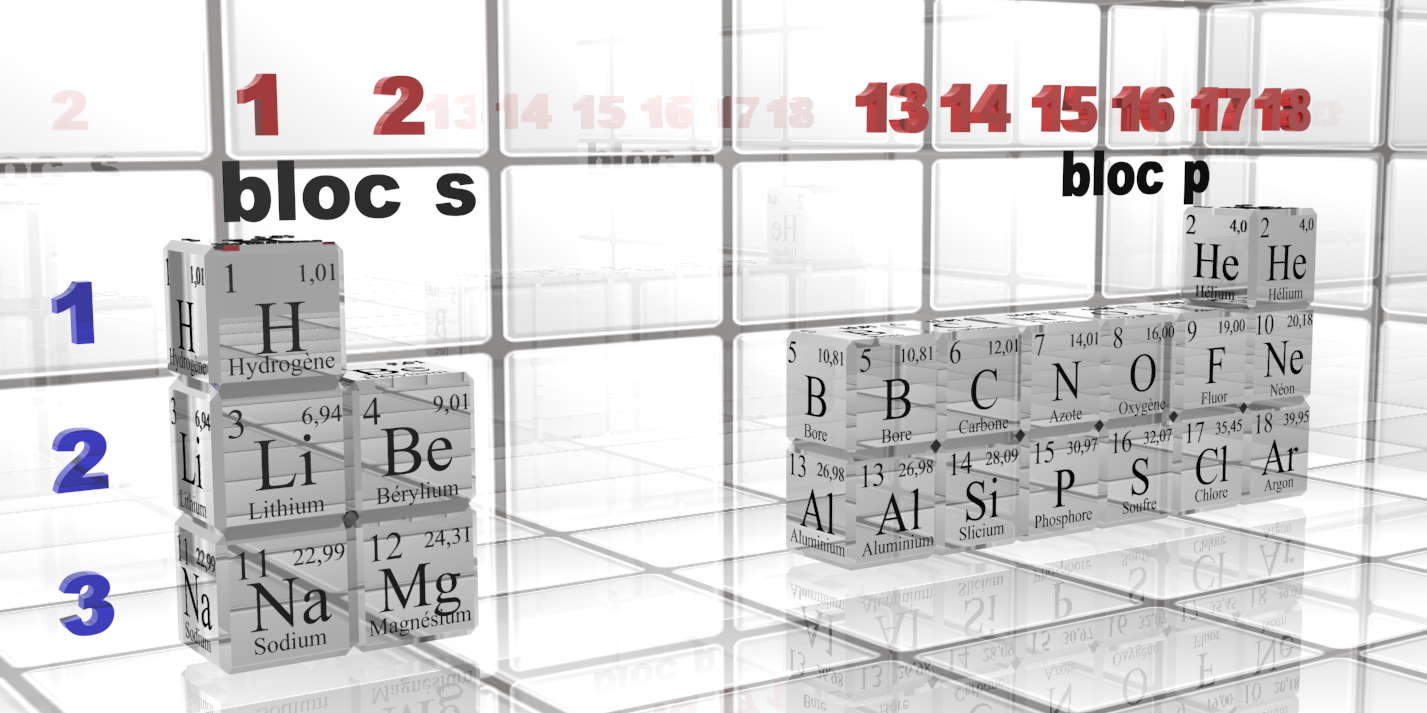
La position d’un élément dans le tableau périodique permet de déterminer le nombre d’électrons de valence de ses atomes.Le schéma de Lewis d’une molécule représente tous les électrons de valence de tous les atomes d’une entité polyatomique.
Objectif : Etablir le schéma de Lewis de molécules à partir du tableau périodique.
|
Doc 1 : extrait de la classification.
|
|
|
|
Doc 4 : Stabilité des éléments. La saturation en électrons de la couche externe assure la stabilité d'un élément. Chaque élément réagira de manière à atteindre cette saturation, comme les gaz rares. |
|
Doc5 : Configuration électronique selon la règle de Klechkowski : · Les niveaux (1s,2s,3s...) sont complétés dans l'ordre indiqué par le schéma de gauche. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p……….. · Deux électrons de spins opposés par cellule : Les cellules de chaque sous-niveau (s,p,d,f) sont remplies selon deux étapes :
électron.
Exemple pour le Titane, Ti de numéro atomique Z = 22 : 1s22s22p63s23p64s23d2 |
A11. Connaître.
$\bullet$ Rappeler comment déterminer le nombre d’électrons de valence d’un atome à partir de la position de l’élément dans le tableau périodique.
A12. Réaliser
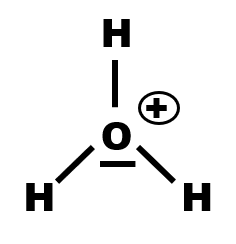
$\bullet$ Déterminer la répartition électronique des atomes de néon et d'argon. Sur un schéma (représentation de Lewis), autour de chaque atome représenté par son symbole, reporter les électrons de valence et les doublets non liants.
$\bullet$ Ecrire la répartition électronique des atomes d'hydrogène, de carbone, d'azote et d'oxygène. Combien d'électrons manque-t-il a chacun pour que sa couche externe soit saturée ?
$\bullet$ Etablir alors la représentation de Lewis de ces atomes.
A13. Communiquer.
$\bullet$ Expliquer alors comment les représentations de Lewis du doc 1. ont été établies.
A14. Réaliser.
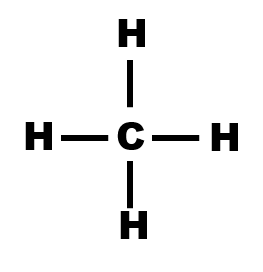
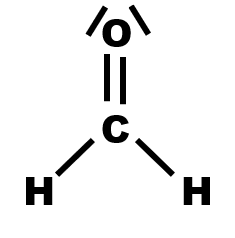
$\bullet$ Etablir alors les représentations de Lewis pour chacune des molécules suivantes : dihydrogène $H_2$, eau $H_2O$, chlorure d’hydrogène $HCl$, diazote $N_2$, dioxyde de carbone $CO_2$ (sachant que les atomes d’oxygène ne sont pas liés entre eux), éthanol $C_2H_5OH$, acétone $CH_3COCH_3$.
A2. Géométrie des entités.
Objectifs :
Interpréter la géométrie d’une entité à partir de son schéma de Lewis.
Utiliser des modèles moléculaires ou des logiciels de représentation moléculaire pour visualiser la géométrie d’une entité.
|
|
|
Doc 3 : Schémas de Lewis
|
|
Doc4 : Méthode VSEPR Il s'agit d'une méthode mise au point par le chimiste Ronald J.Gillepsie (1924-2021) permettant de déterminer la structure géométrique des molécules. Pour un atome central A, entouré de n voisins notés X et de m doublets non-liants, on notera : $A \ X_{ \ n} \ E_{ \ m}$ |
A21. Réaliser
· A l’aide d’un logiciel de représentation moléculaire, construire les modèles numériques des entités du Doc. 1. Utiliser la fonction « optimiser » afin de les représenter dans leur géométrie la plus stable.
A22. Analyser - Raisonner
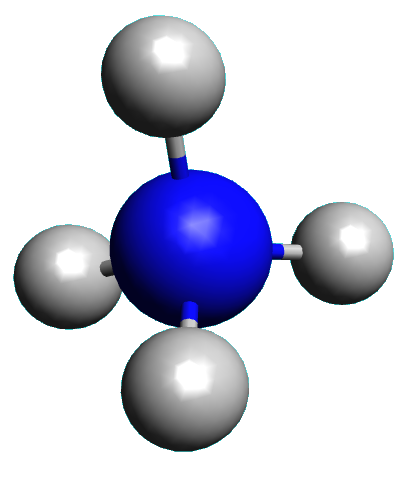
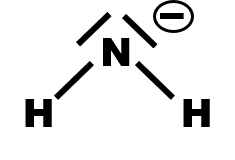
· Nommer la figure géométrique dont les sommets sont occupés par les atomes d’hydrogène de l’ion ammonium.
Déterminer les atomes dont la position n’est pas modifiée lors du passage de $NH_4^{ \ +}$ à $NH_3$. Faire de même pour le passage de $NH_3$ à $NH_2^{ \ -}$
Pour chacune de ces trois entités, compléter le tableau ci-dessous.
|
Entité |
Notation $AX_{ \ n} E_{ \ m}$ |
$n \ + \ m$ |
Répartition géométrique des doublets autour de l'atome d'Azote |
Structure géométrique de la molécule |
 |
||||
 |
||||
 |
A23. Valider
· A l’aide du logiciel de représentation moléculaire ou de modèles moléculaires, déterminer la géométrie des entités eau, ion oxonium et méthane.
Ces géométries auraient-elles pu être prévenues en utilisant les Données et les réponses aux questions précédentes ?
· Proposer un nom pour la géométrie de chacune de ces entités.
A24. Réaliser
· En utilisant le logiciel de représentation moléculaire ou des modèles moléculaires, déterminer la géométrie du méthanal et du dioxyde de carbone.
Donner la notation $A \ X_{ \ n} \ E_{ \ m}$ autour de l'atome central et retrouver la géométrie de la molécule autour de l'atome central A.
A25. Conclure.
Compléter le tableau ci-dessous en utilisant les termes : "tétraédrique", "plane", "linéaire", "pyramidale", "plane coudée"
$A \ X_{ \ n} \ E_{ \ m}$ |
$ n \ + \ m$ |
Répartition géométrique des doublets |
Géométrie de la molécule. |
Exmple. < |
$A \ X_{ \ 4} \ E_{ \ 0}$ |
||||
$A \ X_{ \ 3} \ E_{ \ 1}$ |
||||
$A \ X_{ \ 2} \ E_{ \ 2}$ |
||||
$A \ X_{ \ 3} \ E_{ \ 0}$ |
||||
$A \ X_{ \ 2} \ E_{ \ 1}$ |
||||
$A \ X_{ \ 2} \ E_{ \ 0}$ |
A3. Polarité de la molécule d'eau.
|
Une règle en plastique frottée sur de la laine acquiert une charge électrique qui crée un champ électrique à son voisinage et dévie un filet d'eau mais pas un filet d'hexane.
Pourquoi ? |
 |
Objectifs :
Déterminer le caractère polaire d’une liaison à partir de la donnée de l’électronégativité des atomes
Déterminer le caractère polaire ou apolaire d’une entité moléculaire à partir de sa géométrie et de la polarité de ses liaisons
|
Doc 3 : Electronégativité de quelques éléments.
L'électronégativité d'un élément est une grandeur sans unité qui caractérise la capacité de l'atome à attire à lui le ou les doublets d'électrons d'une liaison dans laquelle il est engagé. |
Réaliser
· Activer la fonction « dipôle » d’un logiciel de représentation moléculaire. A l’aide de cette fonction, représenter l’entité O-H et le vecteur qui lui est associé.
Analyser - Raisonner
· En déduire si l’électronégativité de l’élément hydrogène est égale, inférieure ou supérieure à 3,4.
· Déterminer le caractère polaire ou apolaire de la molécule de fluorure d’hydrogène HF.
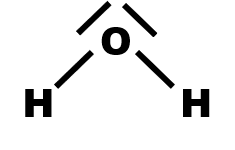
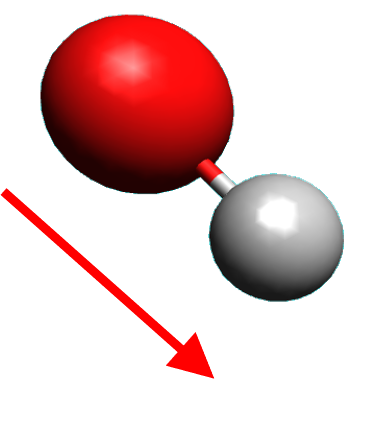
· Déterminer par une construction graphique le caractère polaire ou apolaire de la molécule d’eau.
Valider
· Utiliser le logiciel de représentation moléculaire afin de valider la réponse à la question précédente.
· Expliquer pourquoi on peut affirmer que la photographie en haut de cette page n’a pas été réalisée avec un trucage.
Exerices : 10 , 12, 15 , 17 , 19 , 22 , 24 , 26 , 28 , 30 , 36 , 38 , 43
P73 à 80
COURS
C0. Configuration électronique selon la règle de Klechkowski.
· Les niveaux (1s,2s,3s...) sont complétés dans l'ordre indiqué par le schéma de gauche.
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p...
· Deux électrons de spins opposés par cellule :
Les cellules de chaque sous-niveau (s,p,d,f) sont remplies selon deux étapes :
- Un premier électron de spin ½ par cellule.
- Une fois toutes les cellules remplies de ce premier électron, elles sont complétées par le deuxième
électron.
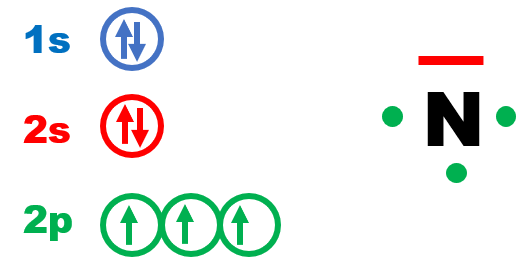
Exemple pour l'azote, N de numéro atomique Z = 7 :
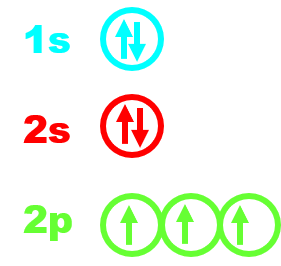 |
N : 1s22s22p3 |
C1. Schéma de Lewis d'une entité chimique.
C11. Stabilité des gaz nobles.
Les atomes des éléments des trois premières périodes de la classification périodique des éléments tendent à la configuration électronique du gaz rare le plus proche dans cette classification.
Ils, formeront des ions ou molécules de telle sorte que leur dernière couche de valence sera saturée à deux ou 8 électrons.
C12. Schéma de Lewis d'un atome ou d'un ion monoatomique.
|
· Le schéma de Lewis permet de représenter la structure électronique externe d'un atome (dernière couche électronique).
· Le noyau de l'atome est représenté par son symbole.
· Les électrons de valence sont représentés :
|
N : 1s22s22p3 |
On admettra que :
- Jusqu'à 4 électrons de valence, les électrons ne sont pas appariés (célibataires, représentés par des points)
- Au-delà, les électrons s'ajoutent aux électrons célibataires pour former des doublets (tiret).
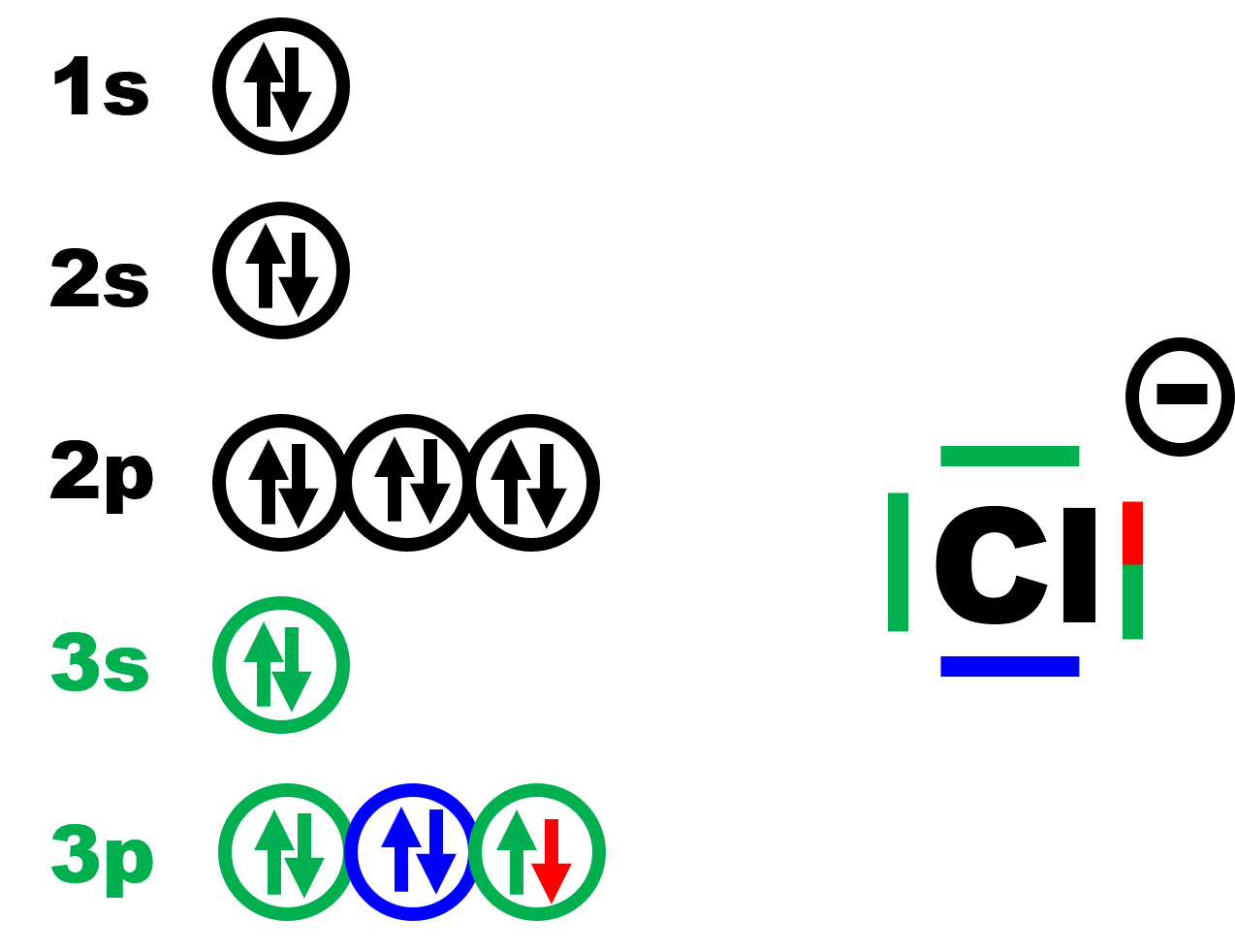
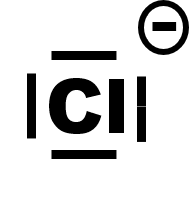
Exemple 2 : l'ion chlorure Cl -, de l'atome de chlore, Cl (Z=17)
· Le chlore a pour configuration électronique : 1s22s22p63s23p5.
· Il possède 2 + 5 = 7 électrons sur sa couche externe.
· Il gagne un électron pour satisfaire à la règle de l'octet et saturer sa dernière couche à 8 électrons.
|
1s22s22p63s23p6 |
finalement :
|
C13. Schéma de Lewis d'une molécule.
On obtient le schéma de Lewis d'une molécule par assemblage des schémas de Lewis des atomes qui la constituent.
· En général, un atome forme autant de liaisons qu'il a d'électrons célibataires.
· L'atome central est celui que forme le plus de liaisons.
· Les atomes mettent en commun leurs électrons célibataires pour former des doublets liants.
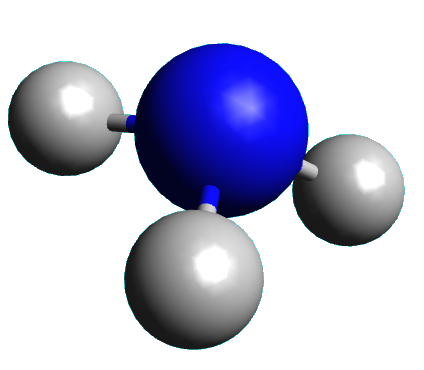
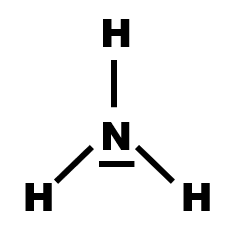
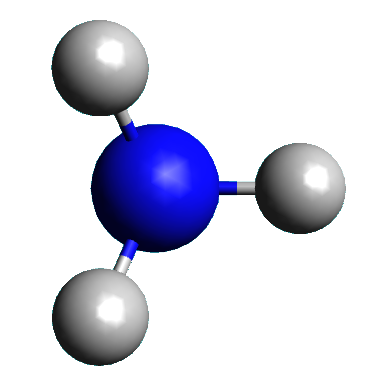
Exemple : L'ammoniac NH3.
Cette molécule est formée d'un atome d'azote et de trois atomes d'hydrogène.

 |
 |
C14. Schéma de Lewis d'un ion polyatomique.
Les atomes des éléments des trois premières périodes de la classification périodique des éléments tendent à la configuration électronique du gaz rare le plus proche dans cette classification.
Un atome engagé dans un ion porte une charge formelle s'il n'est pas entouré du même nombre d'électrons qu'à l'état solide.
|
Exemple 1 : L'atome d'azote N : 1s22s22p3.
Il possède 5 électrons sur sa couche externe. Dans l'ion ammonium, NH4+, l'azote ne possède que 4 électrons, on lui attribue une charge formelle positive symbolisée par le signe ⊕ .
|
Exemple 2 : L'atome d'oxygène O : 1s22s22p4.
Il possède 6 électrons sur sa couche externe. Dans l'ion hydroxyde, HO -, l'oxygène possède 7 électrons, on lui attribue une charge formelle négative symbolisée par le signe ?.
|
C15. Lacune électronique.
La lacune électronique indique un déficit de deux électrons par rapport aux règles de stabilité.
On la représente par un rectangle vide dans le schéma de Lewis.
Exemple : le Bore, B (Z = 5 , 1s22s22p1).
Il ne forme que trois liaisons covalentes, au final, il lui manque donc : 8 – (3+3) = 2 électrons sur sa couche de valence.
 |
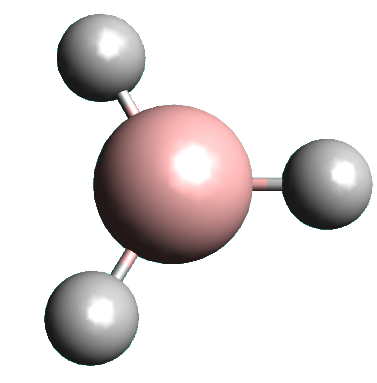 |
C2. Géométrie des édifices chimiques.
Les molécules ou ions polyatomiques s'arrangent dans l'espace de telle sorte que les doublets d'électrons externes soient les plus écartés les uns des autres.
La géométrie des doublets d’un atome dépend :
- du nombre de liaisons (simples ou multiples) autour de l’atome,
- du nombre de doublets non liants autour de l’atome.
| Nombre de liaisons et de doublets non liants | 4 | 3 | 2 |
| Position de l’atome | Centre d’un tétraèdre | Centre d’un triangle | Milieu d’un segment |
| Directions vers lesquelles pointent les doublets non liants et les liaisons | Sommets du tétraèdre | Sommets du triangle | Extrémités du segment |
| Représentation dans l’espace | 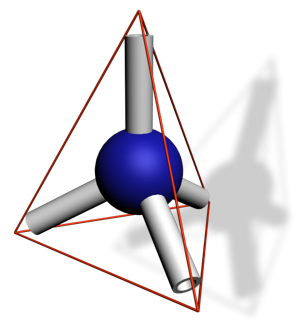 |
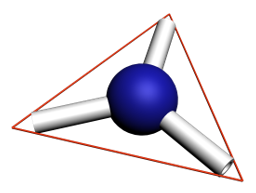 |
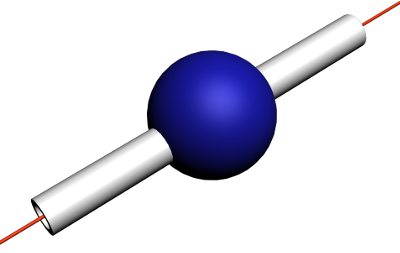 |
Exemples : à vous de jouer !
| Molécule | Représentation de Lewis | notattion $A \ X_{n} \ E_{m}$ | Géométrie |
| CO2 |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
||
| HCN |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
||
| COCl2 |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
||
| CH2O |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
||
| CH3Cl |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
||
| NH3 |
$\square$ linéaire $\square$ triangulaire $\square$ tétraédrique $\square$ pyramidale |
C3. Les molécules polaires et apolaires.
C31. Electronégativité.
Une liaison covalente entre deux atomes correspond à la mise en commun d’un électron externe par chaque atome.
Certains atomes ont tendance à attirer les électrons de la liaison. Ce phénomène est caractérisé par une grandeur : l’électronégativité.
Dans le tableau de la classification périodique des éléments, l’électronégativité augmente de gauche à droite et de bas en haut.
L'électronégativité est une grandeur sans unité qui traduit l'aptitude d'un atome A à attirer à lui le doublet d'électrons qui le lie à un atome B.
Echelle de Pauling des électonégativités.

C32. Polarité d'une liaison.
Une liaison covalente entre deux atomes est polarisée si les deux atomes ont des électronégativités différentes.
Exemple :
Dans le chlorure d'hydrogène HCl, l'atome de chlore est plus électronégatif que l'atome d'hydrogène.
Le doublet d'électrons liant ces deux atomes est plus proche de l'atome de chlore que de l'atome de chlore.
Cette différence de position génère une différence de charge partielle entre les deux atomes.

C33. Polarité d'une molécule.
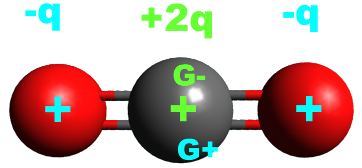
· Une molécule est apolaire si les positions moyennes des charges positives et négatives sont confondues.
Exemple : Le dioxyde de carbone CO2.
 |
Le dioxyde de carbone est apolaire |
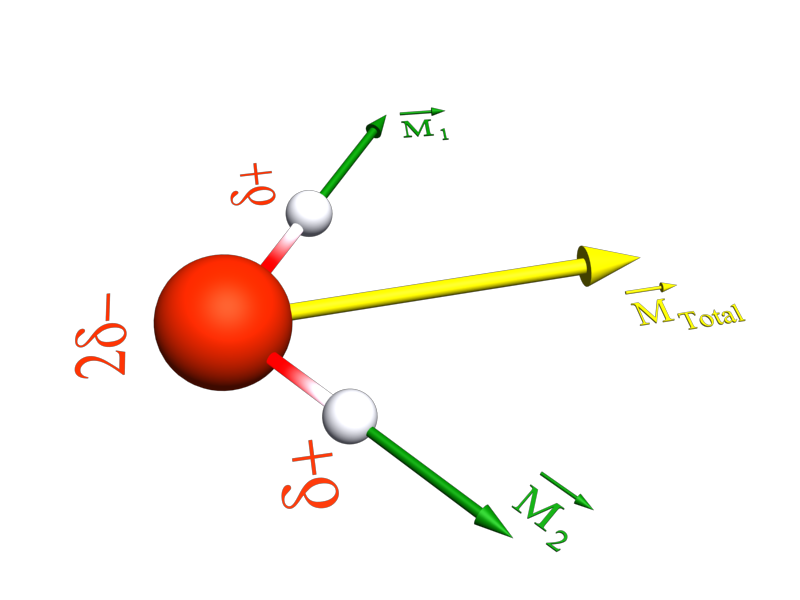
· Une molécule est polaire si les positions moyennes des charges positives et négatives ne sont pas confondues.
 |
L'eau est polaire |
Commentaires
-

- 1. bob_coyote Le 26/11/2022
Le dioxyde de chlore possède un moment dipolaire, sa structure n'est pas linéaire,
On ne peut pas lui appliquer les règles vues en classe de 1ère. -

- 2. Poupart Le 21/11/2022
Qu'en est-il du dioxyde de chlore ClO2 ou O=Cl=O ?
Merci de votre réponse.
Eric
Ajouter un commentaire