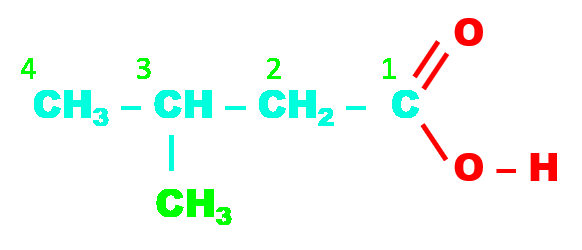Structures et entités chimiques
ACTIVITES
A1. Nomenclature et groupes caractéristiques.
Le nom des composés organiques n'a cessé d'évoluer. Au milieu du XIXème siècle, les chimistes ont établi des règles pour les nommer.
Objectif : Quelles informations révèlent le nom des composés organiques ?
|
Doc 2 : Noms de quelques molécules.
|
|
Doc 3 : Complément scientifique. Dans une molécule, un groupe caractéristique est un groupement d'atomes qui ne contient pas uniquement des atomes de carbone et d'hydrogène. Les familles de composés s'identifient à partir de la présence d'un groupe caractéristique.
|
• Parmi les molécules représentées dans les documents 1et 2 identifier les aldéhydes et cétones les alcools et les acides carboxyliques.
• Nommez la racine pour 1, 2, 3, 4 et 5 atomes de carbone
• Établir un tableau rassemblant les informations contenant le suffixe
• Identifier les différences entre la nomenclature actuelle et celle de la commission de Genève en 1892
• Indiquer l'information fournie par chaque partie du nom d'une molécule : préfixe, racine, et suffixe.
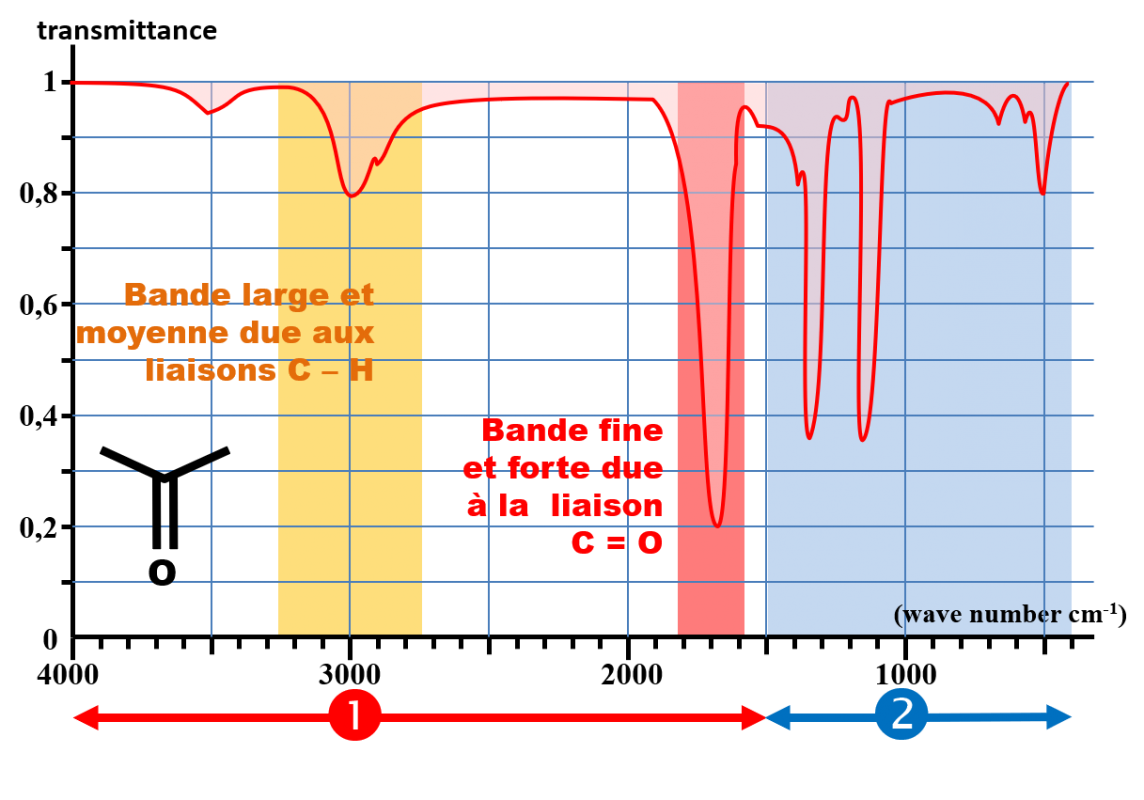
A2. La spectroscopie infrarouge.
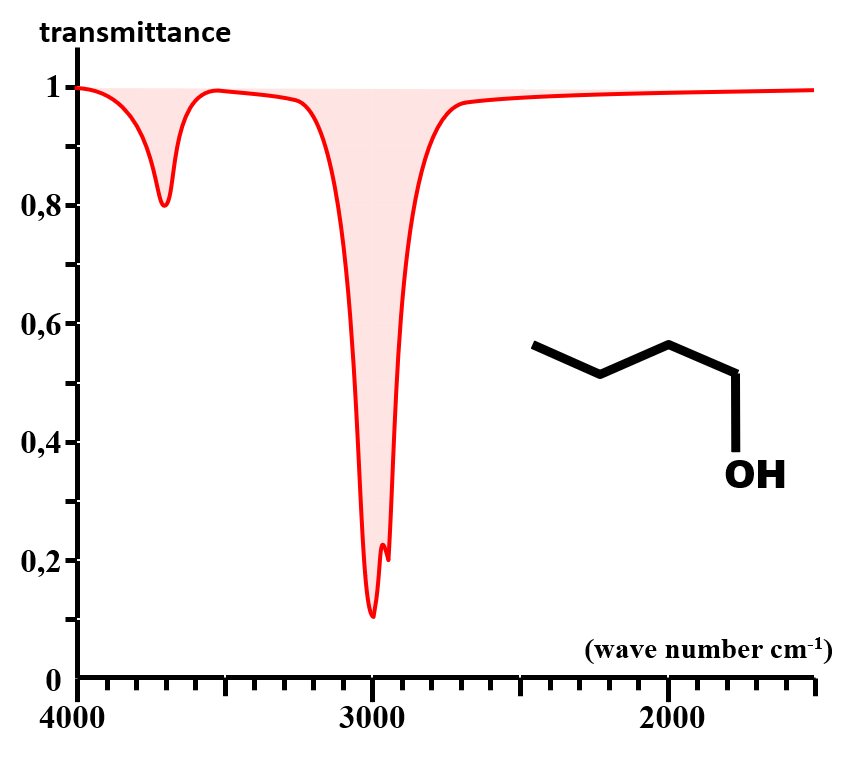
Pour déterminer un taux d'alcoolémie, l'air expiré peut être analysé par spectroscopie infrarouge.
Objectif : Comment identifier un groupe caractéristique par spectroscopie infrarouge ?
|
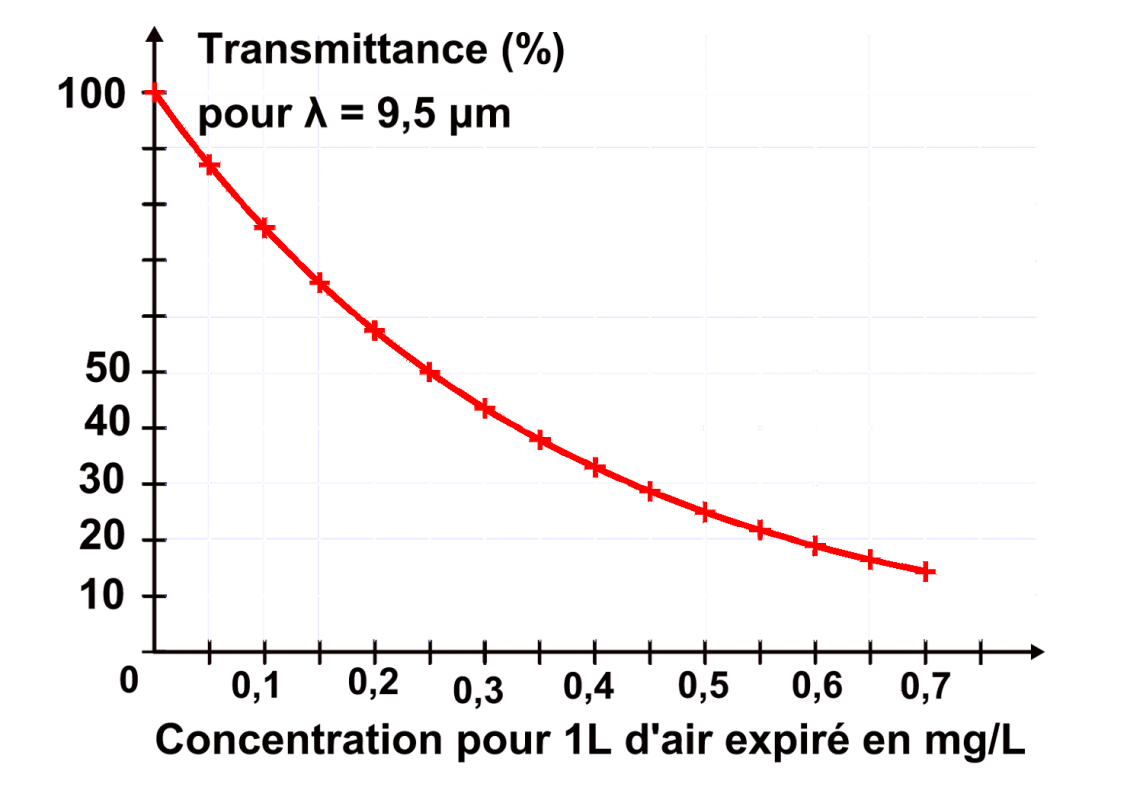
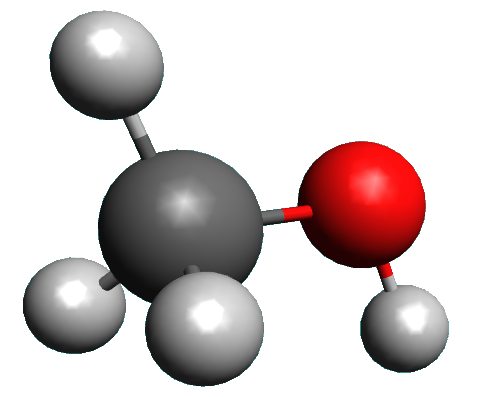
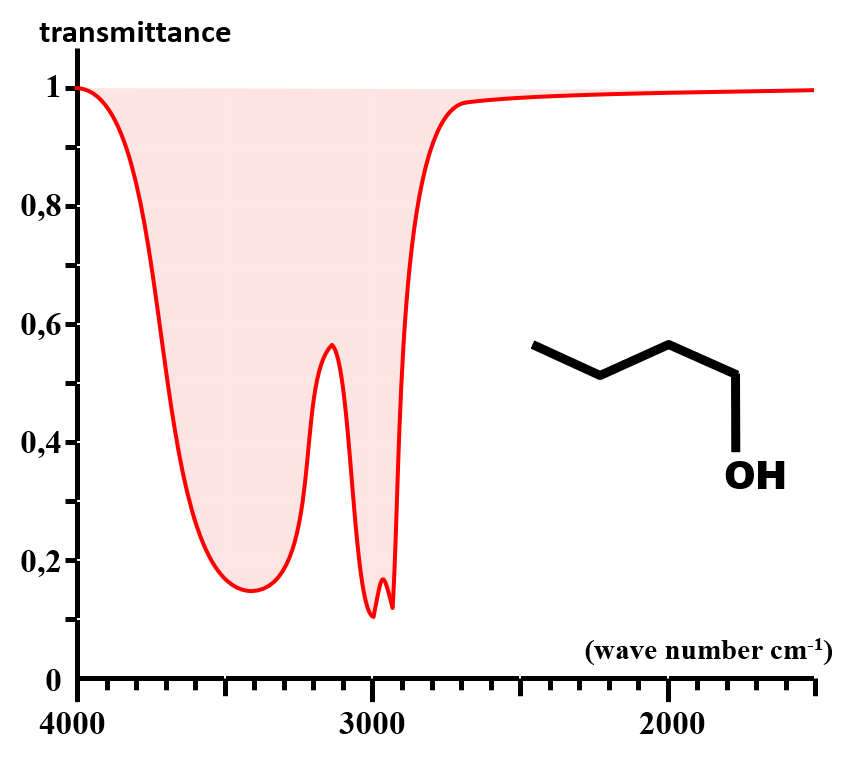
Doc1 : L'éthylomètre à infrarouge. ·Un éthylomètre permet de mesurer la quantité d'éthanol $\left (CH_3 \ - \ CH_2 \ - \ OH \right )$ dans l'air expiré. En France, la limite autorisée du taux d'éthanol et de 0,25 mg par litre d'air expiré. · Un éthylomètre fonctionne sur le principe de l'analyse d'un spectre infrarouge. Les premiers appareils utilisés réalisaient deux mesures pour des longueursd d'onde $\lambda_{1} \ = \ 3,3 \mu m$ et $\lambda_{2} \ = \ 3,5 \mu m$ . La présence d'hydrocarbures dans l'air expiré chez les fumeurs, a conduit les fabricants à développer des appareils effectuant une mesure pour $\lambda_{3} \ = \ 9,5 \mu m$. · Un éthylomètre affiche la concentration massique d'éthanol dans l'air expiré grâce à la mesure de la transmittance qui est reliée à la concentration massique. |
|
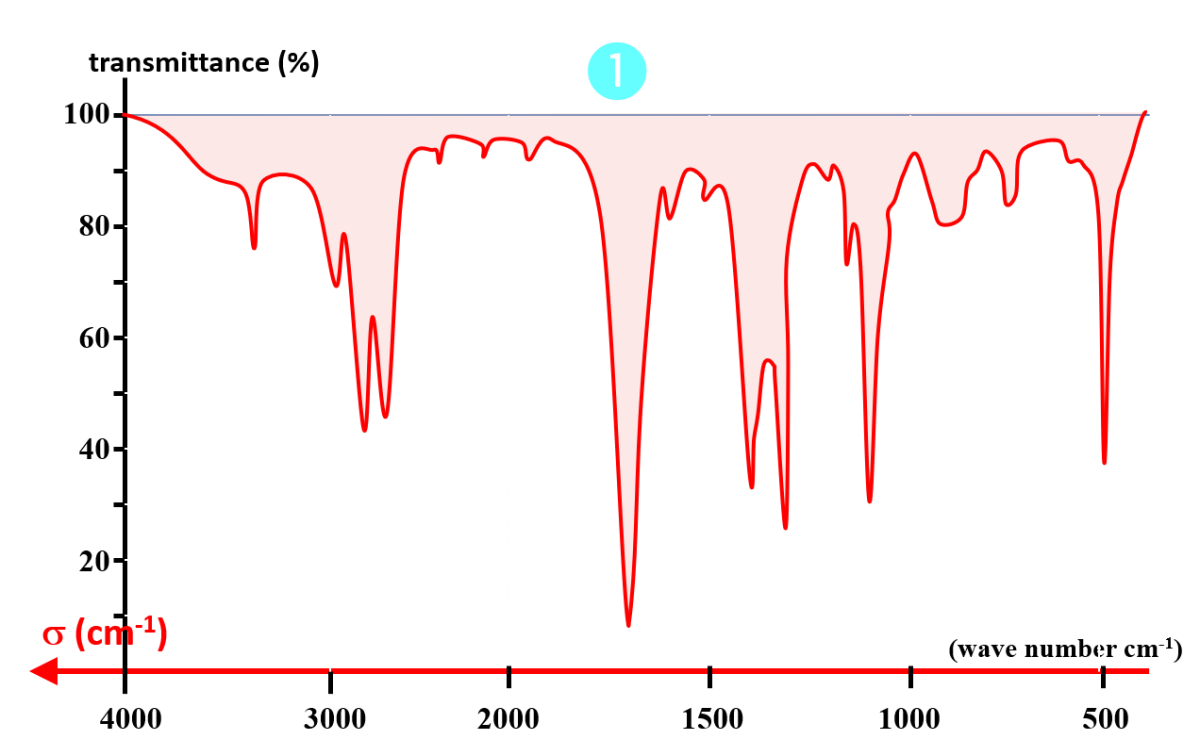
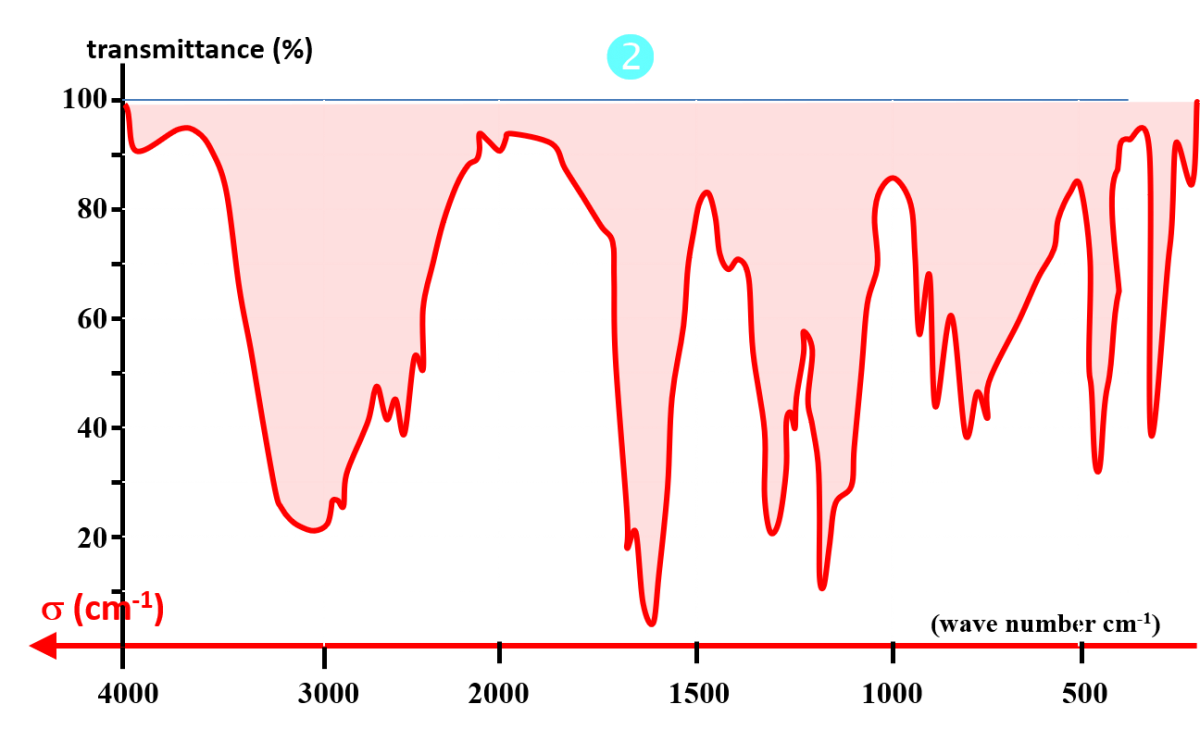
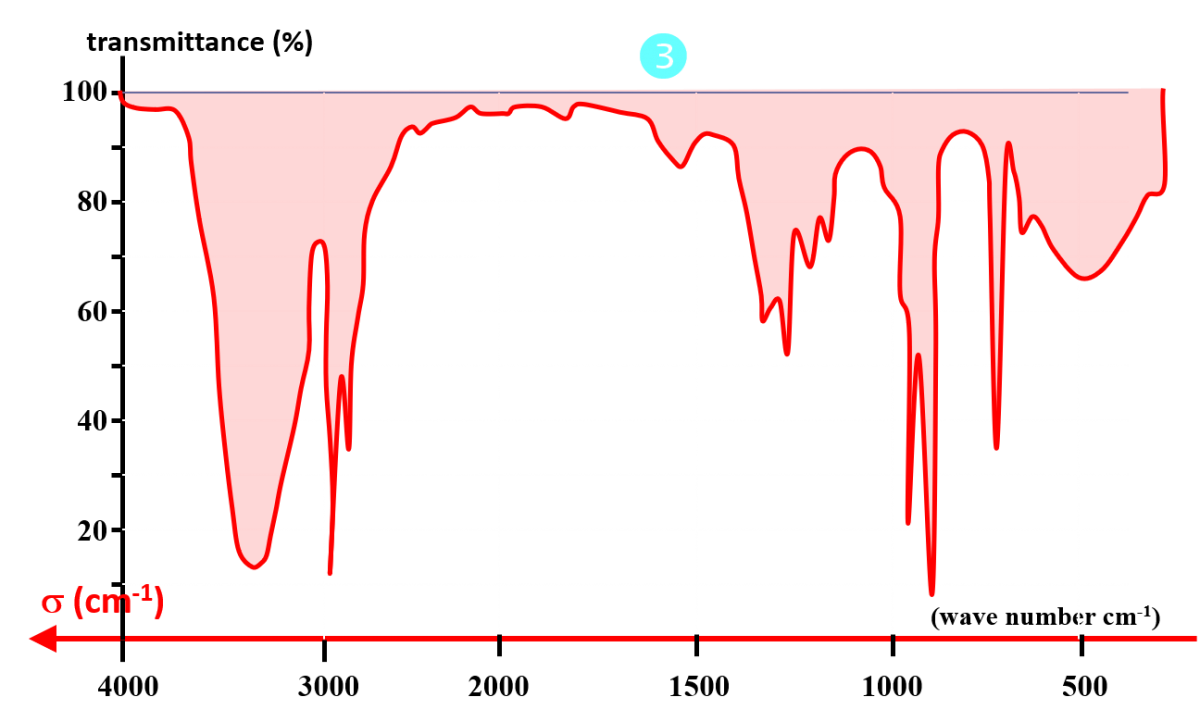
Doc2. Spectres infrarouges de trois espèces chimiques.
|
|
|
•Identifier le groupe caractéristique présent dans la molécule d'éthanol (doc1).
• Déterminer si les bandes de vibration des liaisons O – H et C = O sont présentes dans les spectres du doc2.
• Nommer les groupes caractéristiques présents dans les espèces chimiques dont les spectres sont donnés dans le doc2.
• En déduire le numéro du spectre de l'éthanol.
• Calculer les nombres d'onde σ1 , σ2 et σ3 correspondant aux longueurs d'onde λ1 , λ2 et λ3.
• Les hydrocarbures ont des bandes de vibration de nombre d'onde σ = 3000 cm-1. Expliquer le choix de la longueur d'onde utilisée par les derniers éthylomètres.
• Lors du contrôle routier d'un l'automobiliste l'éthylomètre mesure une transmittance de 40%. L'automobiliste est-il en infraction ?
• Rédiger une synthèse présentant les apports de la spectroscopie infrarouge à l'identification des groupes caractéristiques des molécules organiques.
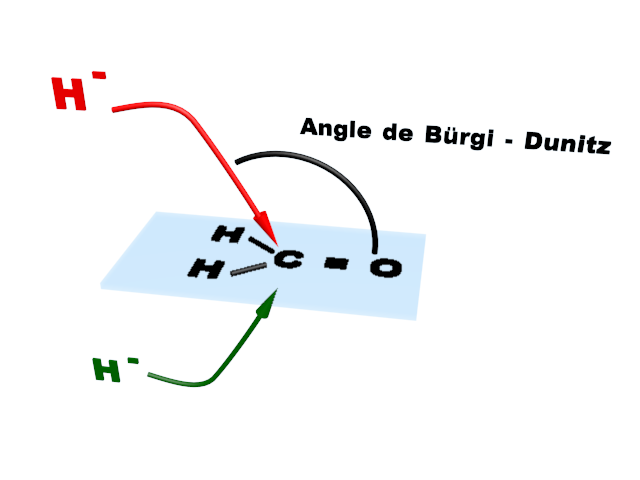
A3. Identification de la géométrie d'une molécule.
La géométrie des molécules organiques influence leur réactivité. Il est donc important de la connaître.
Objectif : Comment connaître la géométrie autour d'un aatome de carbone impliqué dans un groupe caractéristique ?
|
|
|
Doc3. Produits obtenus lors de l'attaque d'un ion hydrure sur différents réactifs.
|
• À l'aide de modèles moléculaires ou d'un logiciel de représentation, expliquer les proportions obtenues lors de l'attaque d'un ion hydrure sur les réactifs (doc3.)
• Construire un tableau regroupant la géométrie autour de l'atome de carbone impliqué dans les groupes caractéristiques décrites dans cette activité.
A4. Nomenclature.
A41. Nommer une molécule représentée.
| 1. | 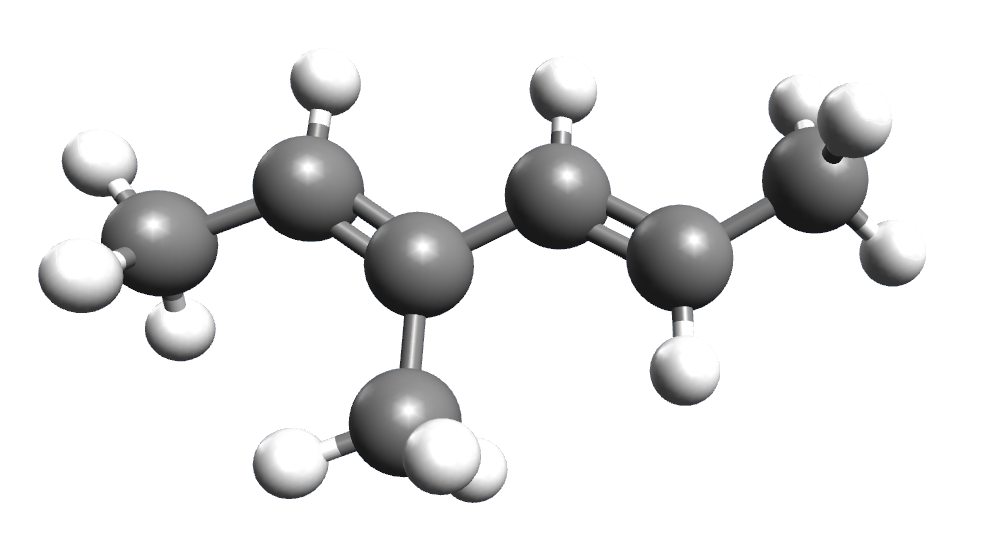 |
|
| 2. | 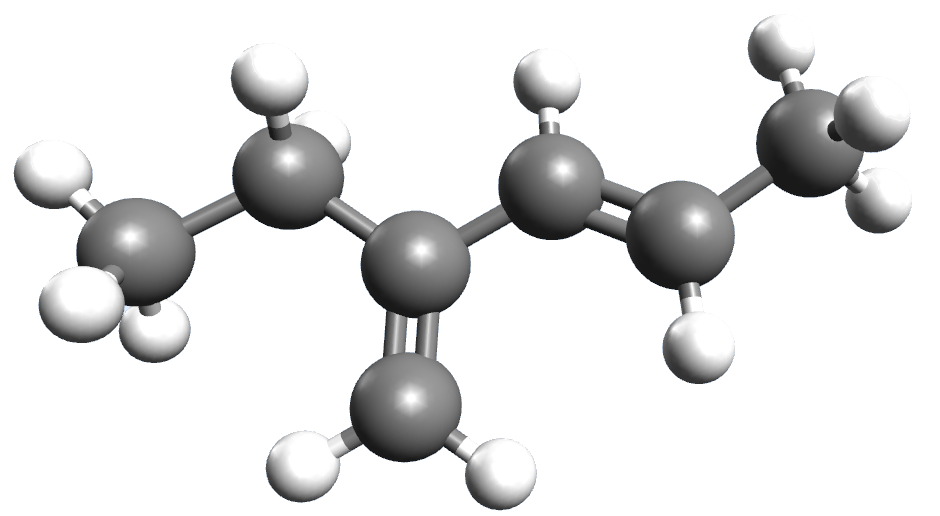 |
|
| 3. |  |
|
| 4. |  |
|
| 5. |  |
A42. Représenter une molécule citée.
| 1. | 2,2-diméthylbutane | |
| 2. | 2-éthyl-3-méthylpent-1-ène | |
| 3. | 3-méthyl-2-propylhexanal | |
| 4. | 2,4-diméthylpentan-3-one | |
| 5. | Acide 4-méthylpentanoïque | |
| 6. | 2-(1-chloréthyl)cyclohexanone |
Exercices : P 117 à 123
10 ; 11 ; 15 ; 16 ; 17 ; 18 ; 19 ; 20 ; 22 ; 24 ; 26 ; 28 ; 30 ; 36 ; 39.
COURS
C1. Les familles de composés organiques.
C11. Modélisations des molécules.
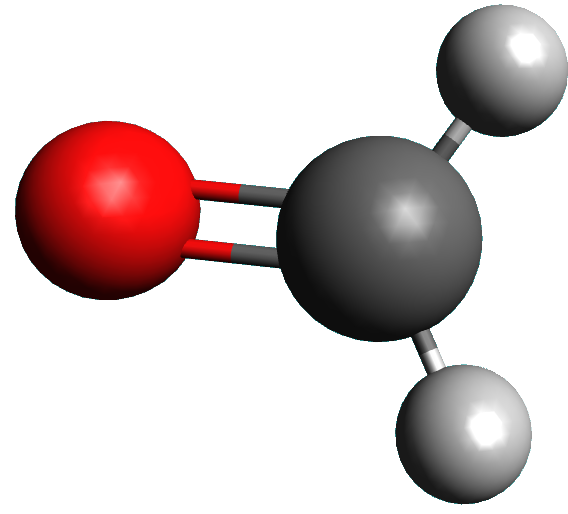
Plusieurs modèles sont utilisés pour représenter les molécules.
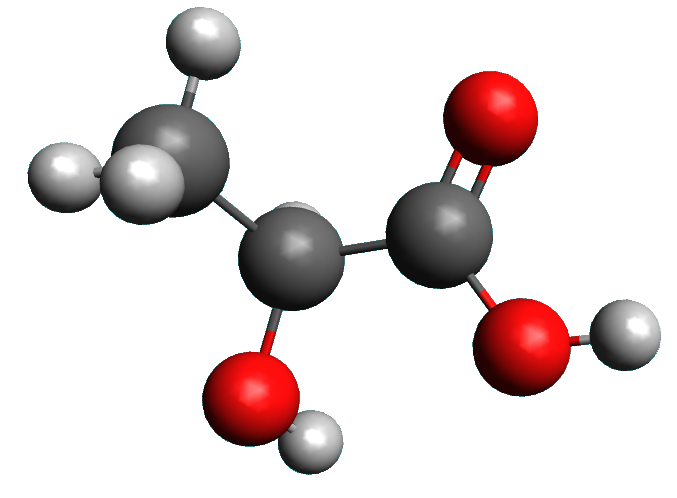
Exemple de l'acide lactique (acide 2-hydroxypropanoïque) :
|
Modèle moléculaire Chaque atome est modélisé par une boule de couleur spécifique. |
Formule brute Elle indique la nature et le nombre des atomes présents dans la molécule.
C3H6O3 |
Formule semi-développée Elle indique l'arrangement des différents atomes présents dans la molécule. |
C12. Groupes caractéristiques et familles de composés.
Une molécule est dite "organique" si elle contient des atomes de carbone et d'hydrogène.
| Famille/Fonction | Groupe caractéristique | Formule générale | ||
| Alcane | Liaisons simples |  |
CnH2n+2 (liaisons simples entre les atomes de carbone). L’alcane peut être ramifié. |
|
| Alcène | Liaison(s) double(s) | 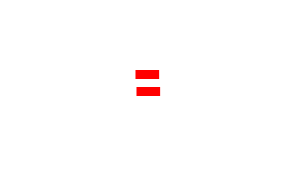 |
CnH2n (présence d’une liaison double entre au moins deux atomes de carbone) |
|
| Alcyne |
Liaison(s) triple(s) |
 |
CnH2n-2 (présence d’une liaison triple entre au moins deux atomes de carbone) |
|
| Alcools |  ?hydroxyle? ?hydroxyle? |
Alcool primaire : le carbone portant le groupement hydroxyle n’est relié qu’à un seul autre atome de carbone. |
Alcool secondaire : le carbone portant le groupement hydroxyle est relié à deux autres atomes de carbone. |
Alcool tertiaire : le carbone portant le groupement hydroxyle est relié à trois autres atomes de carbone. |
| Acide carboxylique |
carboxyle |
 |
||
| Aldéhyde |  |
 |
||
| Cétone |  |
|||
Exemple de l'acide lactique :
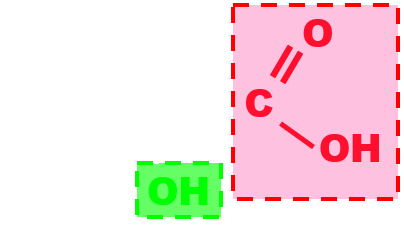 |
Groupe carboxyle. |
|
Groupe hydroxyle. |
C2. Donner un nom à une molécule.
C21. La chaîne principale.
C’est la chaîne carbonée contenant la FONCTION PRINCIPALE et le plus grand nombre de liaisons multiples.
C22. Le préfixe.
Le nom d’une molécule organique dépend du nombre d’atomes de carbone contenus dans sa chaîne principale.
A chaque nombre N correspond un préfixe.
| N | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Préfixe | méth- | éth- | prop- | but- | pent- | hex- | hept- | oct- | non- | dec- | endéc- |
C23. Le suffixe.
A chacunz des familles citées ci-dessus correspond un suffixe à joindre au préfixe.
C23a. En tant que fonction principale :
| Famille | Alcool | Alcène | Alcyne | Alcool |
Acide carboxylique |
Aldéhyde | Cétone |
| Suffixe | -ane | -ène | -yne | -ol | -oïque | -al | -one |
C23b. En tant que fonction secondaire :
| Famille | Alcool | Acide carboxylique | Aldéhyde | Cétone |
| Suffixe | hydroxy | carboxy | oxo ou formyl | oxo |
C24. Ramifications.
Pour chaque ramification :
• Déterminer le nombre d’atomes de carbone qui la constitue pour déterminer le préfixe.
• Déterminer sa position dans la chaîne carbonée principale (la fonction principale doit porter le plus petit nombre possible).
• Si plusieurs ramifications identiques sont présentes, on utilise les préfixes suivants :
| Nombre | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Préfixe | tri- | tétra- | penta- | hexa- | hexa- | hepta- | octa- |
• Le suffixe est -yl .
C25. Le nom.
Remarque :
• Une lettre et un chiffre sont séparés par un tiret.
• Deux chiffres sont séparés par une virgule.
• On ne prend pas en compte les préfixes multiplicatifs pour le classement alphabétique.
C3. La spectroscopie infrarouge
C31 Origines du spectre IR .
Lorsque des molécules sont soumises à des rayonnements infrarouges (entre 2500 et 25000 nm), les liaisons covalentes se mettent à vibrer différemment.
Les molécules absorbent alors ces rayonnements.
C'est la détection de ces absorptions que mesure l'absorption infrarouge.
Différents modes vibratoires de la molécule d'eau.
|
1a.Etirement asymétrique Les élongation et compression des liaisons sont en phase |
1b.Etirement symétrique Les élongation et compression des liaisons sont déphasées |
|
2a.Bascule Les rotations autour de l'atome d'oxygène sont en phase |
2b.Cisaillement Les rotations autour de l'atome d'oxygène sont déphasés |
|
3a.Agitation Les rotations hors du plan sont en phase |
3b.Torsion Les rotations hors du plan sont déphasées. |
C32 Allure des spectres IR .
Les spectres IR présentent en général :
• Le nombre d'onde $\sigma = \dfrac {1}{\lambda} $ en abscisse, exprimé en cm-1. L'échelle est orientée vers la gauche. Elle n'est pas toujours linéaire.
• La transmittance en ordonnée (ou parfois l'absorbance)
|
Chaque bande d'absorption est associée à un type de liaison, caractérisée par les deux atomes la constituant et sa multiplicité. |
C33 Exploitation des spectres IR
|
zone 1 Nombre d'onde compris entre 1500 et 4000 cm-1
Cette zone ne contient qu'un nombre limité de bandes, correspondant à des types de liaisons particulier. Chaque bande est caractérisée par :
Son intensité (faible, moyenne ou forte) |
zone 2 Nombre d'onde compris entre 400 et 1500 cm-1
Il s'agit d'une zone très riche en bandes d'absorption pour les molécules organiques possédant plusieurs atomes de carbone. Elle n'est généralement exploitée qu'en comparaison avec un spectre de référence. Cette zone s'appelle l'empreinte digitale de la molécule. |
C33a Type de liaison.
Pour déterminer le type de liaison correspondant à une bande d'absorption :
a. On relève sa position (abscisse).
b. On s'intéresse à sa largeur.
c. On s'intéresse à son intensité.
C33b Identification de la liaison.
On se reporte à la table des absorptions caractéristiques des liaisons.
| Type de liaison | Nombre d'onde σ (cm-1) | Largeur de la bande | Intensité |
| O - H en phase gazeuse | 3500 – 3700 | fine | moyenne |
| O - H en phase condensée | 3200 - 3400 | large | forte |
| N - H en phase gazeuse | 3300 - 3500 | fine | faible |
| N - H en phase condensée | 3100 - 3300 | large | forte |
| C - H | 2900 - 3100 | large | moyenne à forte |
| C = O | 1700 - 1800 | fine | forte |
| C = C | 1500 - 1700 | variable | moyenne à forte |
table simplifiée
|
La spectroscopie IR permet d'identifier la présence de certains types de liaisons au sein d'une molécule. La plupart du temps, elle permet d'en déduire la nature des groupes caractéristiques de cette molécule. |
C24 Mise en évidence de la liaison hydrogène.
| • En pratique, plusieurs facteurs (masses des atomes, conjugaison du système de liaisons…) influent sur la position et l'allure des bandes d'absorption |  |
|
• Ainsi, la bande fine et de faible absorption due à la liaison O – H en phase gazeuse (3600 cm-1) s'accompagne en phase condensée d'une bande très large et très intense autour de 3300 cm-1.
Cette très grande modification met en évidence la présence de liaisons hydrogène entre les molécules en phase condensée.
NB : Il peut s'agir de liaison O – H et/ou N – H |
 |
 |
 |
Ajouter un commentaire