Titrage Colorimétrique
ACTIVITES
A1. Dosage par spectrophotométrie.
Certaines espèces sont colorés parce qu'elles absorbent une partie de la lumière visible. Cela permet d'analyser les solutions colorées. L'eau de Dakin est un antiseptique dermatologique marron utilisé notamment pour désinfecter la peau avant une intervention médicale.
Objectif : vérifier la concentration d'une solution commerciale à l'aide d'un dosage par étalonnage colorimétrique.
|
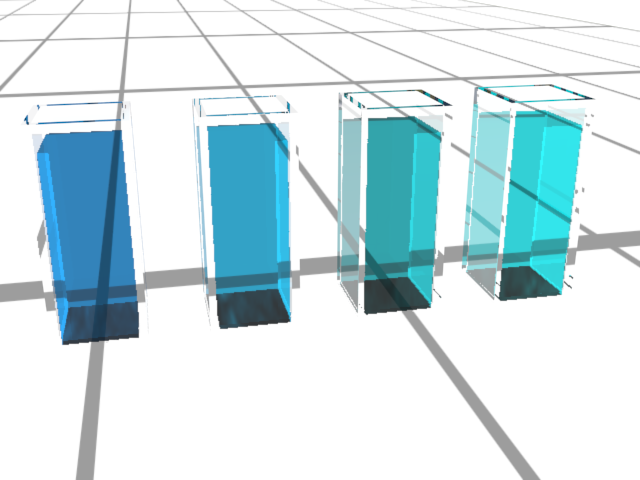
Doc1 : L'eau de Dakin.. L’eau de Dakin est une solution antiseptique utilisée pour le lavage des plaies et des muqueuses ». Il s’agit d’une solution d’hypochlorite de sodium dans laquelle on a dissous du permanganate de potassium de manière à obtenir une concentration massique Cm en permanganate de potassium de $C_m \ = \ 10 mg.L^{ \ -1}$. Parmi toutes ces espèces chimiques, seuls les ions permanganate $MnO_4^{ \ -}$ sont colorés et donnent à la solution cette teinte violette, assimilable au magenta. On veut "doser" les ions permanganate de la solution de Dakin, c’est-à-dire déterminer leur concentration à l’aide d’un spectrophotomètre. On commencera par estimer cette concentration en comparant la solution avec des solutions d’ions permanganate de concentrations connues constituant une échelle de teintes. |
|
|
|
Doc4 : matériel et produits à disposition. $\bullet$ Pipettes jaugées à 5, 10, 20 et 25 mL. $\bullet$ Fiole jaugée de 50 mL. $\bullet$ Eau distillée. $\bullet$ Tableur informatique ou papier. $\bullet$ Solution $S_{B}$ de Bétadine® dermique 10% diluée 10 fois. $\bullet$ Solution aqueuse $S_{ \ 0}$ de permanganate de potassium de concentration $C_{ \ 0} = 1,00 \times 10^{ \ -4} \ mol.L^{ \ -1}$ |
•A partir de la solution S0, compléter le tableau suivant, et faire valider par l'enseignant.
| Solution | S0 | S1 | S2 | S3 | S4 | S5 | S6 |
| Concentration (mmol.L-1) | $2,00.10^{ \ -4}$ | $1,00.10^{ \ -4}$ | $5,00.10^{ \ -5}$ | $4,00.10^{ \ -5}$ | $2,50.10^{ \ -5}$ | $2,00.10^{ \ -5}$ | $1,00.10^{ \ -5}$ |
| Volume de S0 à prélever | ...... | ...... | ...... | ...... | ...... | ...... | ...... |
• Une fois le tableau validé par l'enseignant, réaliser l'échelle de teinte.
• A quelle longueur d'onde se placer pour effectuer les mesures ? Justifier.
• Pour chacune des solutions, mesurer l'absorbance.
| Solution | S0 | S1 | S2 | S3 | S4 | S5 | S6 |
| Absorbance A | .......... | .......... | .......... | .......... | .......... | .......... | .......... |
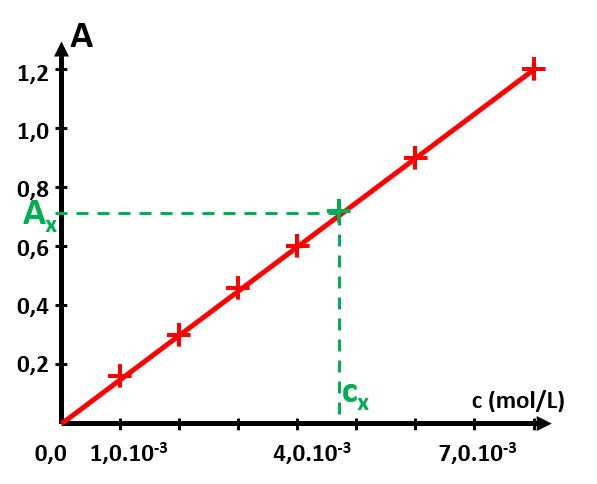
• Tracer le graphe représentant l'absorbance A en fonction de la concentration en diiode c.
• La loi de Beer-Lambert stipule que l'absorbance A est proportionnelle à la concentration c. Cette loi est-elle vérifiée dans notre cas ? Si oui, tracer la fonction correspondant et donner son expression.
• Donner alors la valeur de la concentration en diiode $MnO_4^{ \ -}$ de la solution commerciale.
• Comparer cette valeur à la valeur indiquée sur le flacon.
A2. Dosage par titrage d'une solution colorée.
La povidone iodée, commercialisés sous le nom de Bétadine est employée dans la pharmacopée comme antiseptique.
Objectif : Découvrir le principe d'un dosage par titrage et en faire l'exploitation.
|
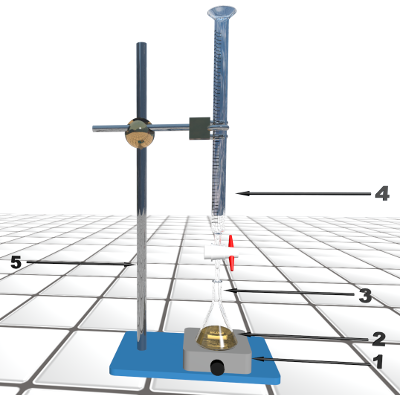
Doc 2 : Matériel et produits. Burette graduée de 25 mL Agitateur magnétique et barreau aimanté Erlenmeyer de 125 mL Pipette jaugée de 10 mL Solution de thiosulfate de sodium de concentration $c \ = 5,00 \ 10^{ \ -3} \ mol.L^{ \-1}$ polyvidone à 10% diluée 10fois. L'indication sur le flacon 10% signifie que le produit contient 10 g de povidone pour 100 mL. |
|
||||||||||||||||||
On envisage le titrage du diiode dont le protocole est donné.
- A l'aide des couples d'oxydoréduction, identifier le réactif titré à le réactif titrant.
- Ecrire la réaction support du titrage.
- Donner le nom correspondant à chaque numéro sur le schéma du montage.
Titrage.
- Réaliser le titrage et noter le volume équivalent VE.
- Justifier que la décoloration indique bien que le titrage a atteint son équivalence.
Exploitation.
- Exprimer la quantité de matière n de réactif titrant apporté à l'équivalence.
- En utilisant l'équation de la réaction de titrage et, éventuellement, un tableau d'avancement, en déduire la quantité de matière de diiode initialement présent, notée n1.
- En déduire la concentration en quantité de matière, puis en masse de polyvidone.
- Comparer cette valeur à celle attendue.
Exercices :
8 ; 10 ; 18 ; 22 ; 23 ; 24 ; 26 ; 28 ; 30 ; 38 ; 40 ; 45 ; 46 P 29 à 38
COURS
C0. Vocabulaire.
C01. Dosage.
Détermination d'une quantité de matière ou d'une concentration.
C02. Dosage par étalonnage.
Détermination de la concentration (ou de la quantité de matière) d’une espèce chimique en solution en comparant une grandeur physique caractéristique de cette solution (par exemple l’absorbance) à celles de solutions étalons.
Il s’agit d’une méthode non destructive car l’espèce à doser demeure intacte.
C03. Dosage par titrage.
Détermination de la concentration (ou de la quantité de matière) d’une espèce chimique dissoute dans une solution, en utilisant une réaction chimique.
Il s’agit d’une méthode destructive car la réaction chimique consomme l’espèce à doser.
C04. Réactif titré.
Espèce chimique de la solution titrée dont on veut déterminer la quantité de matière.
C05. Réactif titrant.
Espèce chimique de la solution titrante, de concentration connue, et qui réagit avec le réactif titré.
C06. Equivalence d'un titrage.
Etat où le réactif titrant et le réactif titré ont été apportés dans les conditions stoechiométriques.
C1. Dosage par étalonnage colorimétrique.
C11. Absorbance et spectre d'absorption.
|
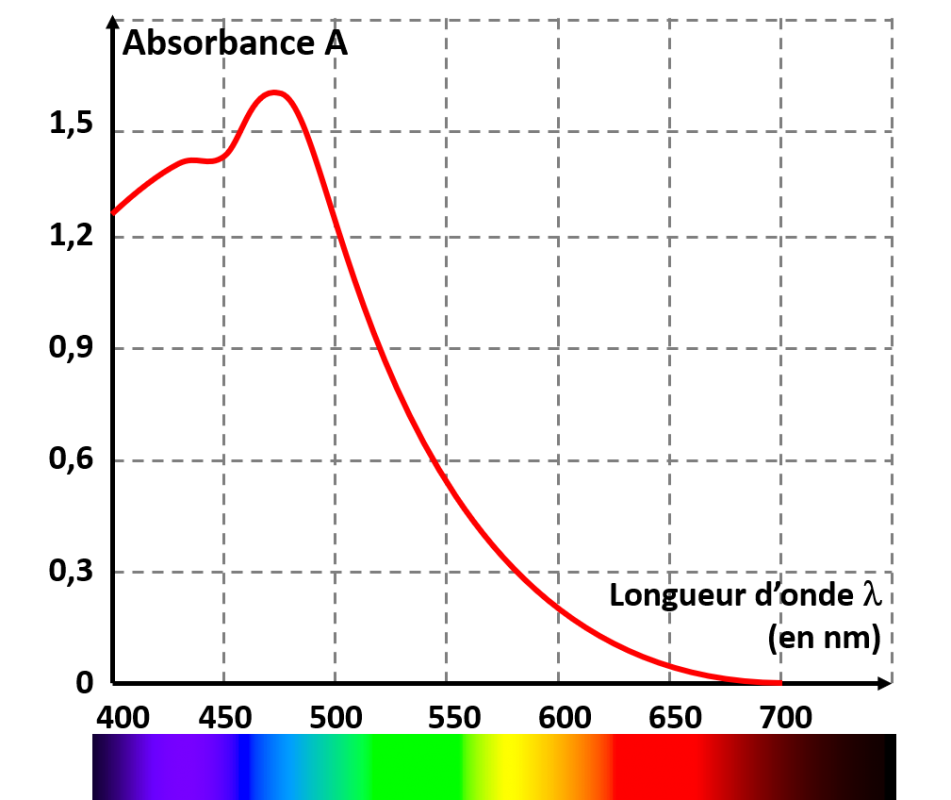
• Le spectre d'absorption d'une espèce chimique en solution est une courbe obtenue à l'aide d'un spectrophotomètre. •Cette courbe représente l'absorbance A de la solution en fonction de la longueur d'onde λ. |
 |
|
L'absorbance représente la capacité d'une solution à absorber la lumière à une longueur d'onde donnée.
|
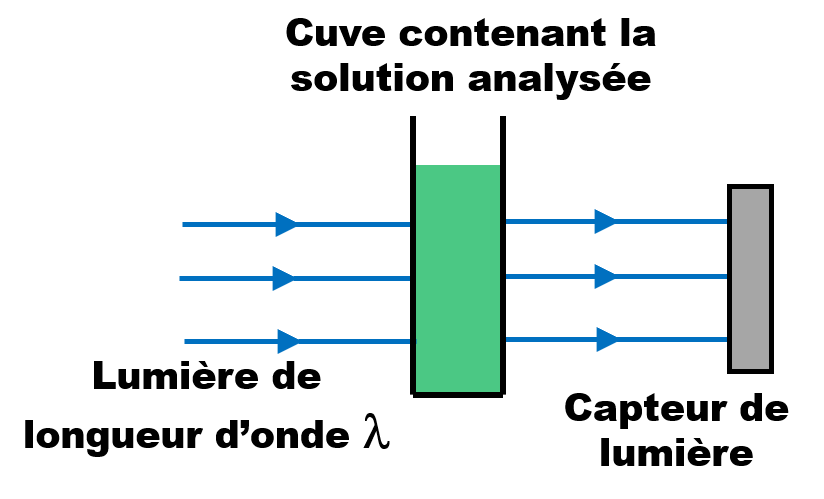 |
C12. Couleur d'une espèce en solution.
|
La couleur d'une espèce chimique en solution est liée à son spectre : c'est la couleur d'une lumière obtenue par synthèse soustractive. La couleur observée est la couleur complémentaire de la couleur absorbée.
Exemple : Le spectre d'absorption d'une solution de sulfate de cuivre montre que cette solution absorbe au maximum dans le rouge. Sa couleur est cyan. |
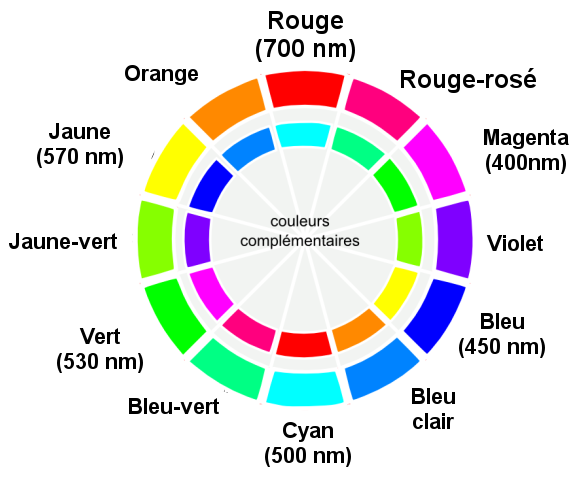 |
C13. Loi de Beer-Lambert.
L'absorbance A d'une solution, contenant une seule substance à la longueur d'onde λ est proportionnelle à la concentration c de cette substance et à la longueur l de la solution traversée :
|
A : absorbance sans unité ε : coefficient d'absorption en L.mol-1.cm-1 l : largeur de la cuve en cm c : concentration molaire en mol.L-1 |
C14. Principe d'un dosage par étalonnage.
|
1. Réaliser une échelle de teintes de concentrations connues de solutions du même soluté que la solution à étudier.
2. Pour chaque concentration c des solutions de l'échelle de teintes, mesurer l'absorbance A.
3. Tracer A en fonction de c. C'est une droite linéaire d'étalonnage si la loi de Beer-Lambert est vérifiée. 4. Mesurer l'absorbance Ax de la solution à analyser et utiliser la courbe précédente pour déterminer sa concentration cx. |
échelle de teintes droite d'étalonnage |
C2. Dosage par titrage.
C21. Définitions et vocabulaire.
|
 |
C22. Equivalence du titrage.
- Avant l'équivalence, le réactif limitant est le réactif titrant, il est totalement consommé.
- A l'équivalence, le réactif titrant a été apporté dans les conditions stoechiométriques : il n'y a plus de réactif titrant, ni de réactif titré.
- Après l'équivalence, le réactif titré est le réactif limitant.
- Le volume équivalent est le volume de titrant qu'il a fallu apporter pour être dans les conditions stoechiométriques.
NB : A l'équivalence, les réactifs sont présents dans les conditions stoechiométriques.
Pour une réaction :
$ a \ A + b \ B \longrightarrow c \ C + d \ D $
$ \dfrac {n_A}{a}= \dfrac {n_B}{b} $
C23. Repérage de l'équivalence.
- Dans le cas où le réactif titré est coloré, sa couleur disparaît à l'équivalence.
- Dans le cas où le réactif titrant est coloré, sa couleur persiste dès l'équivalence.
Remarque :
Dans notre cas, nous n'utiliserons que des titrages colorimétriques.
Dans d'autres cas, l'équivalence peut être repérée autrement : mesure du pH, de la conductivité…
C24. Exploitation.
Lors d'un titrage, les informations nécessaires et utiles sont :
- Les réactifs (titré et titrant) et la réaction support.
- Le volume apporté en titré.
- La concentration en titrant.
- Le volume à l'équivalence.
Ajouter un commentaire