Force des Acides et des Bases
ACTIVITES
A1. Fort ou faible ?
Tous les acides et toutes les bases ne sont pas équivalents et ne se comportent pas de la même façon à l'eau.
Objectif : mesurer le ph de solution d'acide de base de concentration donnée pour en déduire le caractère fort où faible de l'acide ou de la base.
|
Doc1 : Solutions d'acides et de bases.
|
|
Doc3 : Matériel et produits.
|
|
Doc4 : Rôle de l'eau. • L'eau est une espèce amphotère qui peut réagir avec une base en jouant le rôle d'acide, ou avec un acide en joue le rôle de base. La force d'un acide ou d'une base correspond à sa capacité à réagir avec l'eau. • Un acide ou une base est faible si sa réaction avec l'eau n'est pas totale et conduit à un équilibre chimique. • Si la réaction d'un acide ou une base avec l'eau est quasi-totale, l'acide (la base ) est fort (forte). • La réaction entre deux molécules d'eau, l'une jouant le rôle d'acide et l'autre de base conduit à un équilibre appelé autoprotolyse de l'eau et modélisé par l'équation : $2 \ H_2O_{(l)} \overrightarrow{\longleftarrow} H_3O^+_{(aq)} + HO^-_{(aq)} $ · La constante de cet équilibre est appelée produit ionique de l'eau : $K_e = \dfrac {\left [ H_3O^+_{(aq)} \right ] _f \times \left [ HO^-_{(aq)} \right ]_f}{c^2_0} $ avec c0 = 1 mol.L-1 à 25 °C, $Ke = 1,0.10^{ \ -14}$ |
Analyser-raisonner
• Proposer un protocole pour préparer une solution fille de volume V = 100 mL de concentration en quantité de matière Cfille = 5,0.10-2 mol.L-1 à partir d’une solution mère de concentration en quantité de matière Cmère = 0,1 mol.L-1.
Réaliser
• Mesurer le pH des solutions S1 à S4 puis calculer la concentration des ions H3O+ dans chaque solution.
• Compléter le tableau du document 1.
Analyser-raisonner
• Etablir le tableau d’avancement de la réaction entre un acide AH et la base H2O. En déduire l’expression de l’avancement maximal xmax de cette réaction puis la concentration maximale en ions H3O+ ,$ \left [ H_3O^+_{(aq)} \right ] $, obtenue si la réaction est totale.
• Pour chacun des deux acides, la valeur de la concentration en ions oxonium $ \left [ H_3O^+_{(aq)} \right ]_{max} $ à l’équilibre issue de la mesure du pH est-elle proche de la valeur maximale ou nettement inférieure ? L’écart éventuel entre ces deux valeurs parait-il dû aux incertitudes de mesures ?
• Par analogie, déterminer si pour chacune des deux bases, la valeur de $ \left [ HO^-_{(aq)} \right ] $ issue de la mesure correspond à la valeur maximale $ \left [ HO^-_{(aq)} \right ]_{max} $ . L’écart éventuel entre ces deux valeurs peut-il être dû aux incertitudes de mesures ?
• Les réactions avec l’eau des acides et bases utilisés ici sont-elles totales ou non totales ? Réécrire les équations des réactions non totales en utilisant le signe $\overrightarrow{\longleftarrow}$
• A l’oral : L’acide chlorhydrique est dit fort tandis que l’acide éthanoïque est dit faible. La soude est une base dite forte tandis que l’ammoniac est une base faible. En utilisant les résultats, proposer une définition de ces termes.
A2. Détermination d'une constante d'acidité?
| Les vinaigres de ménage contiennent, l'acide éthanoïque dont nous allons déterminer la constante d'acidité qui permet d'évaluer les forces relatives d'acide faible.
|
 |
Objectif : estimer la valeur d'une constante d'acidité à l'aide de mesures de pH.
|
Doc1 : Protocole.
Préparer sept mélanges des solutions A d'acide éthanoïque CH3COOH(aq) et d'éthanoate de sodium $\left ( Na^+_{(aq)};CH_3COO^-_{(aq)} \right ) $ en prélevant les volumes VA et VB indiqués dans le tableau ci-dessous. Homogénéiser les mélanges.
• Mesurer le pH de chacun de ces ménages ; compléter le tableau. • Calculer chacun de ces mélanges $ x= -log \left ( \dfrac {V_B}{V_A} \right ) $ et compléter le tableau. • Tracer l'évolution du pH en fonction de x et ajouter la droite modèle. |
|
Doc2 : Matériel et produits. · Bécher de 100 mL, · Fiole jaugée de 50 mL, · Pipette jaugée de 5,0 mL, 10,0 mL, 20,0 mL et 25,0 mL. · Pissette d'eau distillée. · pH-mètre étalonné. · Solution A d'acide éthanoïque CH3COOH(aq) de concentration cA = 1,00.10-2 mol.L-1. · Solution B de éthanoate de sodium $\left ( Na^+_{(aq)} ; CH_3COO^-_{(aq)} \right ) $ de concentration cB = 1,00.10-2 mol.L-1. · Ordinateur avec un tableur grapheur. |
Réaliser.
· Mettre en œuvre le protocole du document 1.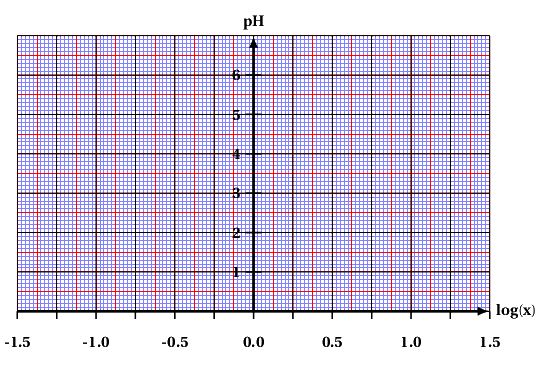
ANALYSER-RAISONNER.
• On suppose que l’acide éthanoïque et l’ion éthanoate ne réagissent pas sur l’eau (c’est-à-dire que leurs concentrations dans les solutions A et B sont égales à c) et que leurs quantités de matière ne changent pas lors du mélange des solutions.
Exprimer leurs concentrations à l’équilibre dans les mélanges effectués, $\left [ CH_3COO^-_{(aq)} \right ]$ et $\left [ CH_3COOH_{(aq)} \right ]$ en fonction de c, VA et VB.
• Montrer que : $log \left ( \dfrac {{\left [ CH_3COO^-_{(aq)} \right ]}_{(éq)}}{\left [ CH_3COOH_{(aq)} \right ]_{éq}}\right )=log \left ( \dfrac {V_B}{V_A} \right ) $
• Montrer que le graphe obtenu est en accord avec la relation : $pH = pK_a + log \left ( \dfrac {{\left [ CH_3COO^-_{(aq)} \right ]}_{(éq)}}{\left [ CH_3COOH_{(aq)} \right ]_{éq}}\right )=log \left ( \dfrac {V_B}{V_A} \right ) $
• En déduire la valeur du pKA du couple étudié.
Réaliser.
· Donner le diagramme de prédominance du couple étudié.
ANALYSER-RAISONNER.
• Comparer la précision de la valeur du pKA déterminée grâce à ce protocole et celle d’une valeur de pKA obtenue par une seule mesure de pH d’un unique mélange d’acide et de base conjugués.
A3. Acides faibles dans l'eau.
L'outil numérique permet, en chimie, d'effectuer des calculs et des tracés à partir de la théorie (constante d'acidité, relation entre pH pKa etc).
Objectif : Utiliser un langage de programmation pour calculer le taux d'avancement final de la réaction entre un acide et l'eau et pour tracer un diagramme de distribution.
|
|
|
Doc3 : Tracé du diagramme de distribution. for i in range (120) : pH.append(1+i/10) pa.append(100/(1+10**(pH[i]-pKa)) pb.append(100-pa[i])
Pour ajouter un élément à la fin d'une liste L, on peut utiliser la fonction L.appen(x) |
A31. Taux d’avancement final d’une réaction entre un acide et l’eau.
Analyser / Raisonner
• Soit AH un acide faible, du couple AH/A-, écrire l’équation de la réaction entre AH et l’eau.
• On note $ \left [ H_3O^+_{(aq)} \right ]_{éq} $ et Ca la concentration de la solution. On néglige les ions issus de l’autoprotolyse de l’eau. Exprimer les concentrations à l’équilibre , puis la constante d’acidité Ka du couple AH/A-, en fonction de h, Ca et C0 =1 mol.L-1.
• Montrer que h est solution d’une équation de la forme $ ah^2+bh+c $, pour laquelle on donnera les expressions de a, b et c en fonction de Ka, Ca et C0.
• Donner l’expression de sa solution positive.
Réaliser
Compléter le programme tauxavancement.py fourni (document 1) et le vérifier sur l’exemple du document 3.
Analyser / Raisonner
Pourquoi ce programme ne permet-il pas de prendre en compte des cas où la concentration Ca est très faible ?
A32. Diagramme de distribution
Le programme diagrammedistribution.py fourni réalise le diagramme de distribution d’un couple acide-base.
Réaliser
Exécuter ce programme sur l’exemple du doc.3 pour afficher le diagramme produit.
Analyser / Raisonner
• Le doc.2 reproduit un extrait du programme. Expliquer comment est construite la liste pH, et en particulier pourquoi on a choisi 120 itérations.
• En utilisant la définition de la constante d’acidité Ka du couple AH/A- ou la relation entre pH et pKa, montrer que $\left [A^-_{(aq)} \right ] = \left [ AH_{(aq)} \right ] \times 10^{pH-pK_a}$ .
• Si l’on note pb le pourcentage de l’espèce basique A- et pa le pourcentage de l’espèce acide conjuguée AH, montrer que $pb = pa \times 10^{pH-pK_a} $ : et pb + pa = 100 %.
• Montrer, en résolvant ce système d’équation, que les lignes de calcul des listes pb et pa du programme calculent bien ces pourcentages.
A4. Titrage d'un vinaigre.
|
Le vinaigre est une solution aqueuse d'acide éthanoïque caractérisée par son degré d'acidité, il est lié à sa concentration en acide éthanoïque également appelée acide acétique.
Objectif : vérifier par des titrages pH-métrique et colorimétrique le degré d'acidité d'un vinaigre commercial. |
 |
|
|
|
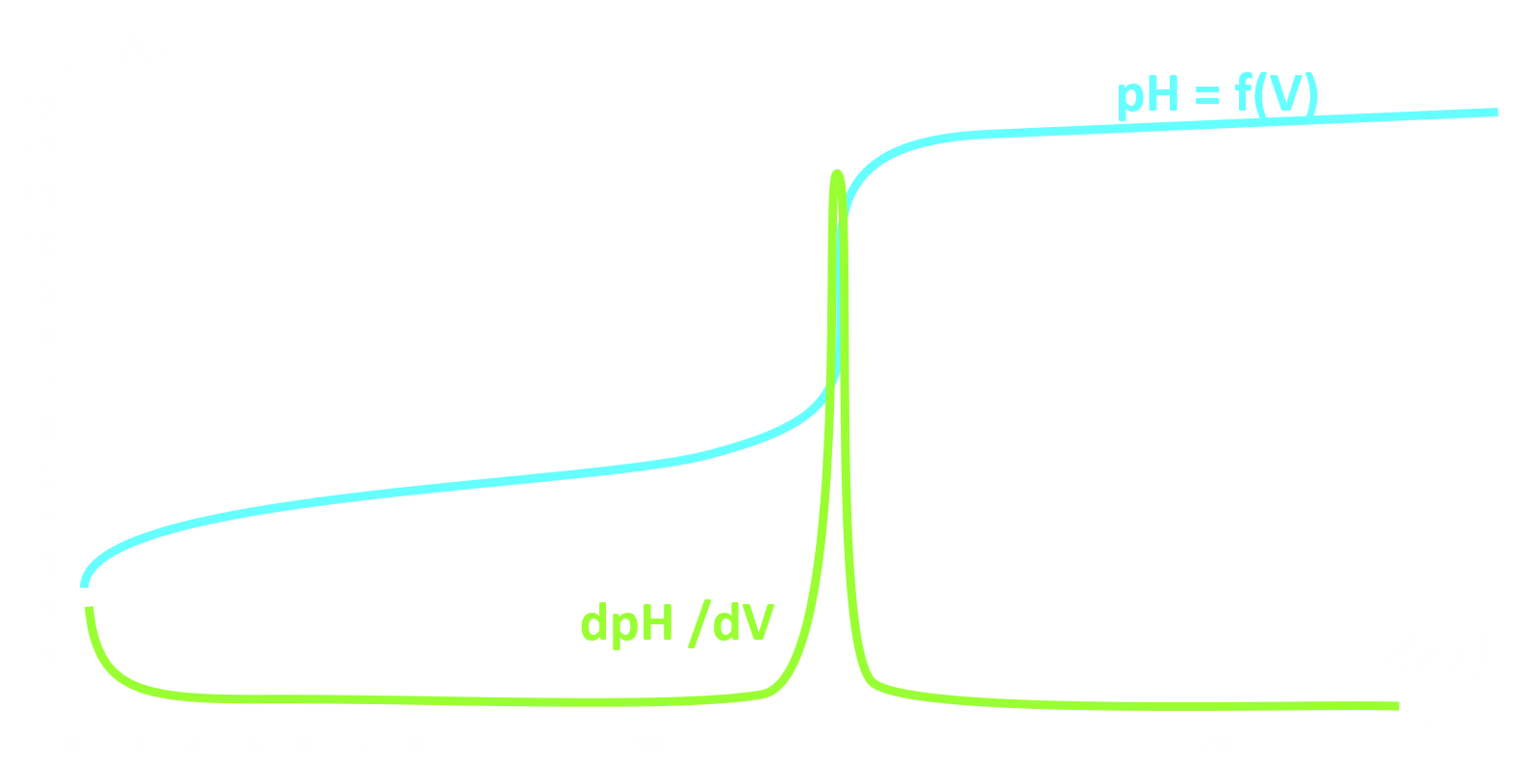
Doc.2 : Evolution du pH en fonction du volume versé.
|
|
Doc.4 : Degré d’acidité d’un vinaigre La teneur acétique des vinaigres, exprimée en degrés acétimétriques, est égale à leur acidité totale exprimée en grammes d’acide acétique pour 100 millilitres de vinaigre mesurés à la température de +20 °C. Une différence de 0,2°, soit 2 grammes d’acide acétique par litre de vinaigre, peut être admise en moins, dans la mesure de cette teneur. |
|
Doc.5 : Quelques indicateurs colorés
|
Réaliser
• A l’aide du document 2, déterminer les coordonnées du point équivalent $E \left (V_E;pH_E \right )$
• La demi-équivalence du titrage est atteinte lorsque la moitié du volume équivalent de solution titrante a été versée. Le pH du mélange est alors au pKA du couple de l’acide faible mis en jeu. Déterminer graphiquement le pKA du couple de l’acide éthanoïque
Analyser / Raisonner
• Déterminer quel indicateur coloré peut-être choisi pour repérer l’équivalence de ce titrage la zone de virage de cet indicateur. A quel intervalle de volumes de solution titrante cela correspond-il ?
Réaliser
• Réaliser le titrage colorimétrique du vinaigre dilué avec l’indicateur coloré choisi à la question précédente. Noter le volume VE2 pour lequel on observe le virage de l’indicateur. Le résultat est-il cohérent avec le précédent ?
Analyser / Raisonner
• Ecrire l’équation de la réaction support du titrage.
Réaliser /Analyser / Raisonner
• Pour chaque volume équivalent relevé, calculer la concentration du vinaigre dilué, puis en déduire le degré d’acidité du vinaigre commercial (document 4)
Valider
• Pour chaque méthode de titrage employée ici, calculer le quotient $\dfrac {\left | d-d_{ref} \right |}{u(d)}$ où dréf est le degré d’acidité indiqué par le fabricant, en estimant l’incertitude associée à ces mesures du degré d’acidité d à u(d) = 0,2. Conclure.
• A l’oral : Faire la liste des avantages et des inconvénients de chaque méthode.
Exercices : 9 ; 11 ; 12 ; 14 ; 16 ; 17 ; 18 ; 19 ; 22 ; 24 ; 26 ; 33 ; 36 P 173 à 179
COURS
C1. Définition du pH.
C11. pH et acidité.
| Définition : |
|
L'ion H3O+ provient de la protonation des molécules d'eau. Les protons H+ ne peuvent rester seuls dans un milieu aqueux. Ils se lient par liaison hydrogène aux doublets non liants de l'oxygène de la molécule d'eau.
A 25°C, le pH d'une solution aqueuse est compris entre 0 et 14.
Plus une solution contient d'ions H3O+, plus son pH est faible et plus elle est acide.
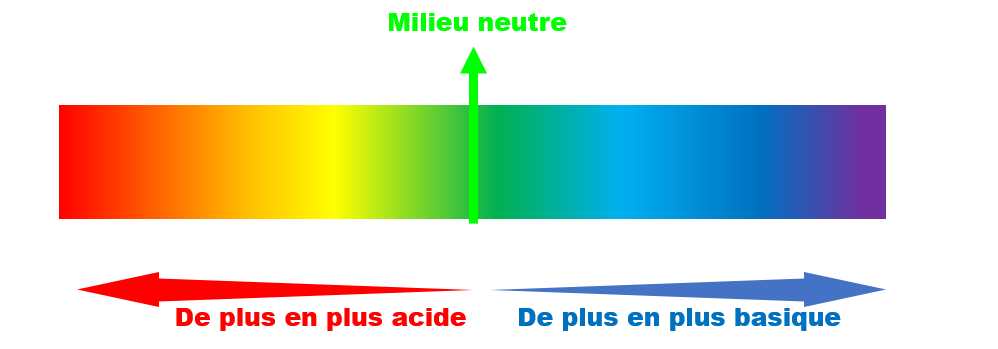
C12. Mesure du pH.
|
Le papier pH permet de déterminer approximativement le pH d'une solution. Il contient des indicateurs colorés de pH dont les couleurs varient en fonction du pH. |
Le pH peut être déterminer plus précisément à l'aide d'un pH-mètre étalonné avec des solutions de pH connus. • Pour mesurer le pH d'une solution acide, on l'étalonne avec des solutions tampons à pH = 7 et pH = 4. • Pour mesurer le pH d'une solution basique, on l'étalonne avec des solutions tampons à pH = 7 et pH = 9. |
C2. Equilibre acido-basique.
C21. Produit ionique de l'eau.
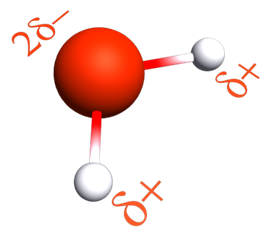 |
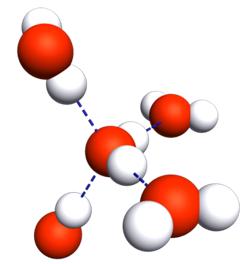 |
La molécule d'eau est polarisée à cause de l'importante différence d'électronégativité entre les atomes d'hydrogène et de l'atome d'oxygène.
Il se forme donc des liaisons hydrogène entre l'atome d'oxygèned'une molécule avec l'atome d'hydrogène d'une autre molécule.
Cet équilibre se traduit par :
$2 \ H_2O_{(l)} \overrightarrow{\longleftarrow} H_3O^+_{(aq)} + HO^-_{(aq)}$
On parle d'autoprotolyse de l'eau.
On appelle produit ionique de l'eau, noté Ke la grandeur sans dimension :
$K_e =\left [ H_3O^+_{(aq)}\right ] \times \left [ HO^-_{(aq)}\right ] = 10 ^{-14} \ à \ 25°C $
C22. Acides et bases : définitions.
 |
En 1923, le chimiste danois Joannes Brönsted (1879 – 1947) propose une interprétation des réactions qui se produisent entre les acides et les base, ou réactions acido-basiques :
|
C23. Couples acide/base.
|
Deux entités forment un couple acide/base s'il est possible de transformer l'une en l'autre par perte ou gain d'un seul ion hydrogène. Les deux entités sont dites conjuguées. |
De manière générique, on symbolise un acide par la notation AH, qui va céder un proton H+ et former sa base conjuguée notée A-.
Ces deux espèces forment le couple acide/base noté AH /A-.
La demi-équation reliant l'acide et la base d'un même couple est une demi-équation acido-basique :
$AH_{(aq)} \overrightarrow{\longleftarrow} A^-_{(aq)} + H^+_{(aq)}$
NB1 : Dans cette notation, la double flèche indique qu'elle se produit dans les deux sens, simultanément, et que par conséquent, elle n'est pas totale.
NB2 : Certaines espèces peuvent se comporter en acide ou en base. Ce sont des ampholytes qui appartiennent donc à plusieurs couples acide/base.
C24. Réaction acido-basique.
|
Deux couples acide/base interviennent au cours d'une réaction acido-basique. L'ion H+ cédé par un acide AH est capté par la base B d'un autre couple. Les espèces conjuguées sont formées : $AH_{(aq)} + B_{(aq)} \overrightarrow{\longleftarrow} A^-_{(aq)} + BH^+_{(aq)}$
|
C25. Notion d'équilibre chimique.
|
Un système chimique, siège d'une réaction limitée atteint un équilibre chimique lorsque les concentrations des espèces présentes n'évoluent plus. Cet état d'équilibre est dynamique : la réaction ne cesse pas, mais deux transformations inverses ont lieu simultanément.
|
NB : Dans ce cas, le réactif limitant ne disparaît pas totalement à l'état final.
L'avancement maximal xmax n'est pas atteint.
L'avancement final xf observé est forcément inférieur à l'avancement maximal.
C26. Acides forts, bases fortes.
Ce sont des entités dont la réaction avec l'eau est totale.
|
Acide Fort
Dans ce cas : $pH=-log (c) $ |
Base Forte
Dans ce cas : $pH=-log \dfrac {K_e}{c} $ |
|||||||||||||||||||||||||||||||||||||||||
C27. Réaction acide fort / base forte.
|
• Les acides et les bases sont corrosifs. • Le contact avec la peau ou l'œil peut provoquer de graves brûlures. • D'autre part, leur réaction avec l'eau entraine une élévation de la température. • Si de l'eau est versée dans un acide fort ou une base forte, il y a risque de projection. • Le port des lunettes, de la blouse et des gants est obligatoire lors de leur manipulation. |
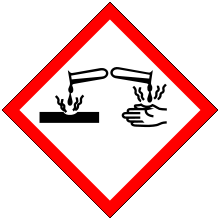 |
Réaction :
Dans une réaction d'acide fort, ce dernier réagit totalement pour donner des ions $H_3O^+$.
Dans une réaction de base forte, cette dernière réagit totalement pour donner des ions $HO^-$ .
La réaction entre un acide fort et une base forte est quasi-totale et se rapporte donc à :
$ H_3O^+_{(aq)} + HO^-_{(aq)}\overrightarrow{\longleftarrow} 2 \ H_2O_{(l)}$
C28. Acides faibles.
Un acide AH est dit faible si sa réaction avec l'eau n'est pas totale et conduit à un équilibre.
| Equation : | $ AH_{(aq)} + H_2O_{(l)}\overrightarrow{\longleftarrow} A^-_{(aq)} +H_3O^+_{(aq)}$ | ||||
| Avct | x=0 | ni | solvant | 0 | 0 |
| x | ni -x | solvant | x | x | |
| x = xf | ni -xf | solvant | xf | xf | |
NB : La réaction n'étant pas totale, on a xf < n0 et donc : $\left [ H_3O^+_{(aq)} \right ] = \dfrac {x_f}{V} < \dfrac {n_0}{V} \ soit \ pH > -log(c) $
C29. Bases faibles.
Une base B est dite faible si sa réaction avec l'eau n'est pas totale et conduit à un équilibre.
| Equation : | $ B_{(aq)} + H_2O_{(l)}\overrightarrow{\longleftarrow} BH^+_{(aq)} +HO^-_{(aq)}$ | ||||
| Avct | x=0 | ni | solvant | 0 | 0 |
| x | ni -x | solvant | x | x | |
| x = xf | ni -xf | solvant | xf | xf | |
NB : La réaction n'étant pas totale, on a xf < n0 et donc : $\left [ HO^-_{(aq)} \right ] = \dfrac {x_f}{V} < \dfrac {n_0}{V} \ soit \left [ HO^-_{(aq)} \right ] =
\dfrac {K_e}{\left [ H_3O^+_{(aq)} \right ] }=\dfrac {x_f}{V} < \dfrac {n_0}{V} \ soit \ pH < -log \left ( \dfrac {K_e}{c} \right )$
C3. Comprendre : pH et équilibre chimique du vivant.
C31. Définition du pKa.
• L'état d'équilibre où les concentrations de l'acide et de la base conjuguée n'évoluent plus se traduit par une constante, propre à chaque couple acide/base qui ne dépend plus que de la température.
|
Un couple ACIDE FAIBLE / BASE FAIBLE AH / A- est caractérisé par sa constante d'acidité Ka, grandeur sans dimension définie par : $K_a=\dfrac {\left [ H_3O^+_{(aq)} \right ]_f \times \left [ A^-_{(aq)} \right ]_f}{\left [ AH_{(aq)} \right ]_f}$ où $\left [ H_3O^+_{(aq)} \right ]_f , \left [ A^-_{(aq)} \right ]_f \ et \ \left [ AH_{(aq)} \right ]_f$ sont les concentrations à l'état final. On associe à cette grandeur le pKa défini par : $pK_a = -log K_a$ |
· Plus le pKa d'un couple est grand (ou plus la constante d'acidité Ka est faible), moins l'acide se dissocie dans l'eau (plus il est faible).
· En général, une modification de la concentration d'une espèce au sein d'un système chimique à l'équilibre provoque une évolution de ce système qui tend à s'opposer à cette modification.
· Quelques valeurs de pKa (les pKa varient de 0 à 14).
| Couple Acide / Base | pKa |
| $H_3O^+_{(aq)} / HO^-_{(aq)}$ | 0,0 |
| $HF_{(aq)} / F^-_{(aq)}$ | 3,2 |
| $HCOOH_{(aq)} / HCOO^-_{(aq)}$ | 3,8 |
| $CH_3COOH_{(aq)} / CH_3COO^-_{(aq)}$ | 4,8 |
| $CO_2,H_2O_{(aq)} / HCO^-_{3(aq)}$ | 6,4 |
| $NH^+_{4(aq)} / NH_{3(aq)}$ | 9,2 |
| $HCO^-_{3(aq)} / CO^{2-}_{3(aq)}$ | 10,3 |
| $H_2O_{(l)} / HO^-_{(aq)}$ | 14,0 |
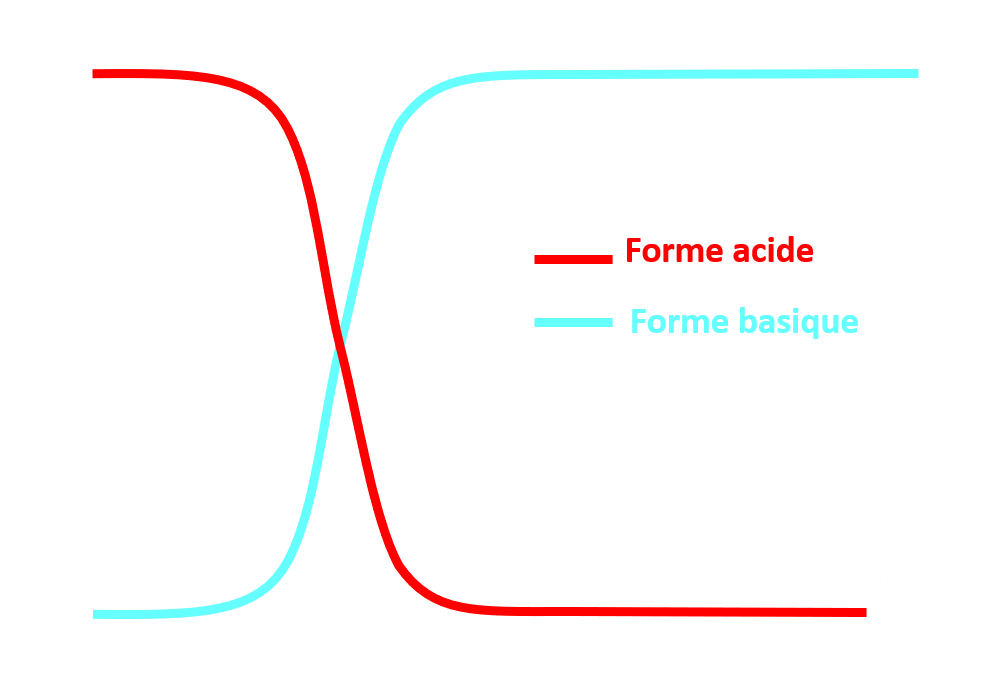
· Diagramme de prédominance.
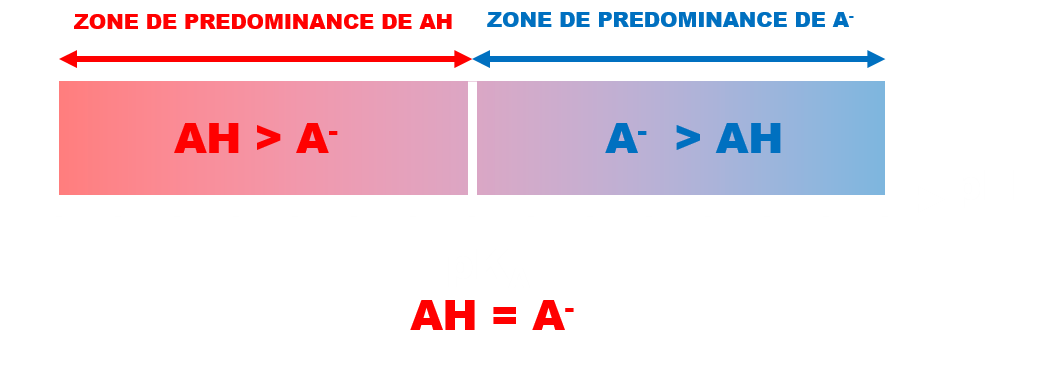
C32. pH et milieux biologiques.
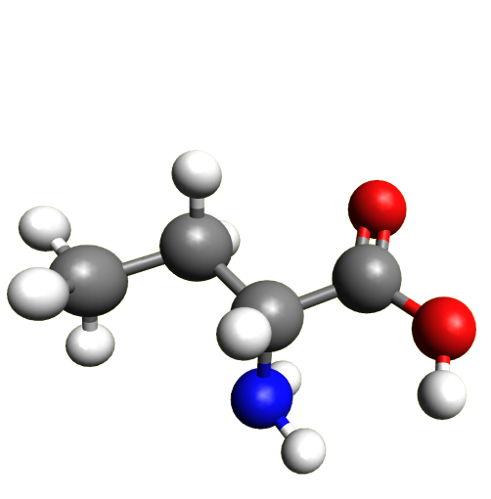
C321. Les acides $\alpha$ - aminés.
|
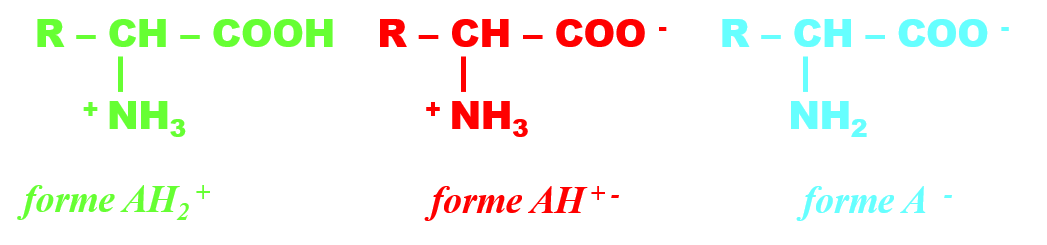
Ce sont des molécules organiques qui comportent un groupe carboxyle et un groupe amine sur le même carbone (dit alpha). Ils jouent un rôle important dans le vivant, car ils s'assemblent pour former des macromolécules : les protéines.
Leur groupe carboxyle leur donne la propriété d'un acide, et le groupe amine, celui d'une base. De ce fait, ils existent sous trois formes : $\color {#00ff00}{AH^+_{2(aq)}} , \color {red}{AH^{+ \ -}_{(aq)}} \ et \ \color {blue}{A^{ -}_{(aq)}}$.
|
 |
Ces molécules constituent deux couples acide/base AH2+ / AH+ - de pKa1 et AH+ - / A- de pKa2.
Le diagramme de prédominance comporte alors trois zones :
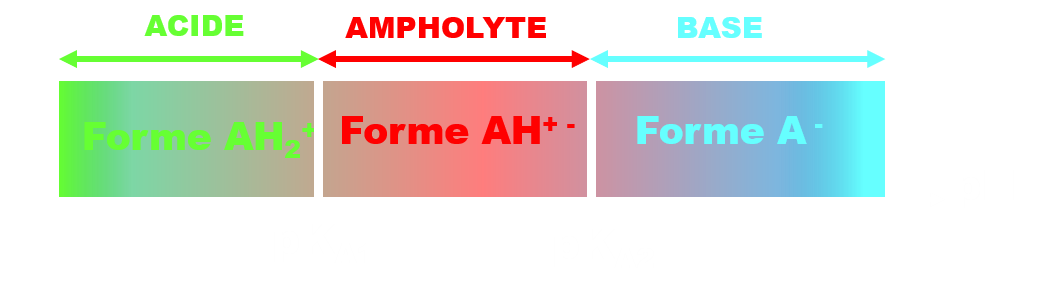
C322. Effet tampon.
Une solution tampon est une solution dont le pH varie très peu lorsque l'on ajoute des quantités modérées d'acide et / ou de base, ou par dilution modérée.
Dans les processus biochimiques des organismes vivants sont extrêmement sensibles aux variations de pH : l'activité enzymatique dépend du pH et les cellules peuvent subir des dommages irréversibles lorsqu'il sort de certaines limites. Le pH des milieux biologiques comme le sang est régulé par un ensemble de solutions tampons qui minimisent les variations de pH.
from pylab import *
print("") print("*******************************")
print("* Diagramme de distribution *")
print("") print("Attention : le separateur decimal est le point")
print("") pKa=float(input("pKa du couple : "))
Pb=[]
Pa=[]
pH=[]
for i in range(120) :
pH.append(1+i/10) Pa.append(100/(1+10**(pH[i]-pKa)))
Pb.append(100-Pa[i])
### Ecriture des resultas print("")
xlim(0, 14)
ylim(-1, 101)
plot(pH, Pa, "r", label="Espèce acide")
plot(pH, Pb, "b", label="Espèce basique")
xlabel ("pH")
ylabel ("Pourcentages")
legend() grid(True)
show()
Ajouter un commentaire