Forcer Evolution Chimique
ACTIVITES
A1 : Electrolyse de l'eau.
Il est possible de décomposer l'eau par électrolyse en utilisant une source d'énergie électrique. Ainsi le dioxygène respiré par les occupants dans un sous-marin les produits par électrolyse de l'eau de mer.
Objectif : Effectuer l'électrolyse de l'eau faire son bilan électrique et chimique.
|
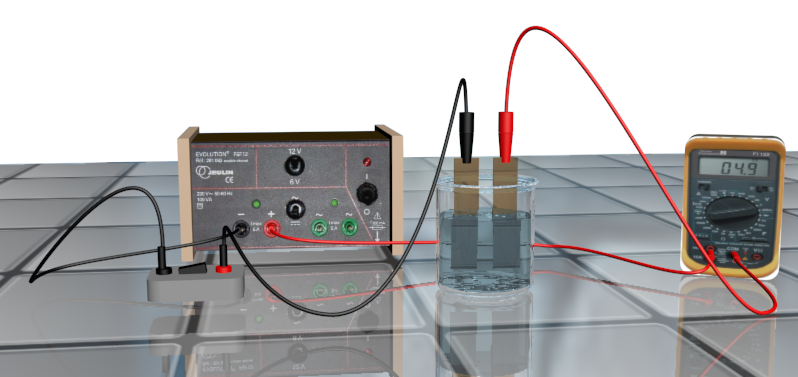
Doc1 : électrolyse de l'eau.
• Réaliser le montage ci-contre verser dans la cuve de l'électrolyseur environ 250 ml de solution de sulfate de sodium. • Enfiler les gants, remplir une éprouvette de 100 ml d'eau distillée à ras bord. La boucher avec le pouce, la retourner et la placer au-dessus de la première électrode en prenant garde à ne pas avoir de bulles d'air emprisonnées. Faire de même avec l'autre éprouvette. • Fermer l'interrupteur et déclencher le chronomètre. Vérifier que les bulles apparaissent à chaque électrode. Notez la valeur de l'intensité I. Vérifier que I reste pratiquement constante au cours du temps et ouvrir l'interrupteur quand l'une des deux éprouvettes contient 100 mL de gaz. • Arrêter le chronomètre noter la durée Dt de l'électrolyse • L'électrode reliée à la borne positive du générateur est nommée anode, celle reliée à la borne négative cathode. Mesurer les volumes de gaz Va et Vb. • Procéder aux tests de reconnaissance pour identifier ces deux gaz. |
|
|
1. Réaliser le protocole.
2a. Reproduire le schéma de l'électrolyseur et le compléter en indiquant le nom des gaz dégagés dans les éprouvettes, le sens du courant électrique, les mouvements des électrons et des ions sulfate de sodium.
2b. Ecrire les demi-équations électroniques ayant lieu à l'anode et à la cathode en précisant s'il s'agit d'une oxydation ou d'une réduction. Ecrire l'équation de la réaction d'électrolyse.
3a. Calculer les quantités de matière n(H2) et n(O2) formées. Est-ce conforme à la réaction de l'électrolyse écrite à la question 2b ?
3b. Déduire des demi-équations la quantité de matière n(e) d'électrons échangés, puis la quantité d'électricité qui correspondante. Vérifier que Q = I× Δt.
4. L'implosion lors du test de reconnaissance du dihydrogène est expliquée par la réaction spontanée et totale entre le dihydrogène dans l'éprouvette et le dioxygène de l'air. Vérifier que cette réaction est la réaction inverse de l'électrolyse.
A2. Raffinage du cuivre.
Le cuivre issu des procédés d'affinage métallurgiques à haute température contient moins de 1,0% d'impuretés qui altèrent les propriétés électriques où thermiques du cuivre. Une électrolyse est réalisée afin de retirer ces éléments et purifier le cuivre.
Objectif : Etudier le transfert de matière d'une électrode à l'autre par électrolyse.
|
Doc1 : Électro affinage du cuivre. • Décaper soigneusement les deux lames de cuivre avec une feuille de papier abrasif et mesurer leurs masses initiales m1 et m2. • Placer les lames dans l'électrolyseur et verser la solution acidifiée de sulfate de cuivre dans la cuve. Les lames doivent tremper dans la solution. • Réaliser le montage ci-dessous :
• Fermer l'interrupteur, régler aussitôt l'intensité à la valeur I = 0,50 A et déclencher le chronomètre. • Laisser l'électrolyse se dérouler pendant Δt = 10 min et s'assurer que la valeur de l'intensité du courant reste égale à 0,50 A en corrigeant éventuellement grâce au bouton de réglage du générateur. Ouvrir l'interrupteur, éteindre le générateur, retirer les lamelles et sécher délicatement avec un sèche-cheveux. Mesurer les masses finales m'1 et m'2 des deux lames. |
|
|
• Écrire les demi-équations des transformations chimiques ayant lieu à l'anode, à la cathode et en déduire l'équation de fonctionnement de l'électrolyseur.
• La quantité d'ions cuivre II dans la solution varie-t-elle lors de l'électrolyse ?
• Calculer la constante d'équilibre de cette réaction.
• Calculer et comparer les variations de masse Δm1 un et Δm2 des électrodes.
• Calculer la quantité d'électricité Q échangée. En déduire la quantité de matière n(e-) d'électrons échangés, celle n(Cu) de cuivre passant théoriquement d'une électrode à l'autre et la masse m correspondante. Comparer m à la masse déposée sur la cathode et commenter le résultat.
• Justifier l'appellation d'électrolyse à anode soluble et expliquer pourquoi le cuivre déposé sur la cathode est plus pur que le cuivre quittant l'anode.
A3. Electrozincage.
Objectif : étudier le dépôt d'un métal sur une pièce par électrolyse.
|
Doc1 : Expérience. • Décaper soigneusement une lame d'acier avec une feuille de papier abrasif de façon que sa surface soit bien lisse. Rincer abondamment à l'eau. • Plonger la lame dans un bécher contenant 50 mL d'acide chlorhydrique pendant une minute environ. • Récupérer la lame, la rincer puis la sécher avec du papier absorbant. • Peser la lame et noter sa masse m. • Préparer la solution électrolytique dans un bécher en y versant 100 mL de solution aqueuse de chlorure de zinc et 100 mL de solution aqueuse de chlorure d'ammonium. • Y introduire la plaque d'acier reliée au pôle négatif du générateur et les deux lames de zinc branchée en série et reliées au pôle positif du générateur. • Déterminer l'aire S de la surface immergée de la plaque d'acier, assimilée à celle des deux faces rectangulaires immergées. • Réaliser le montage de électrozincage schématisé ci-dessous.
• Fermer l'interrupteur, régler aussitôt l'intensité à la valeur I = 0, 40 A et déclencher le chronomètre. • Laisser l'électrolyse se dérouler pendant 10 minutes, en vérifiant que l'intensité reste constante. • Sortir la lame d'acier et la sécher délicatement au sèche-cheveux point • Mesurer sa nouvelle masse m'. |
|
Doc2 : Matériel. • Bécher. • Balance. • Chronomètre, sèche-cheveux. • Deux plaques de zinc, une plaque d'acier. • Générateur électrique avec ampèremètre. • Papier abrasif papier absorbant gants de protection. • Solution de chlorure de zinc II à 0,5 mol/L. • Solution de chlorure d'ammonium à 3 mol/L. • Solution d'acide chlorhydrique à 2 mol/L. • Fils de connexion, interrupteur, pinces crocodile.
|
• Réaliser le protocole. Quel est l'intérêt d'avoir deux électrodes de zinc ?
• Écrire la demi-équation chimique ayant lieu aux électrodes de zinc.
• Comment se déplacent les ions zinc dans le bécher ?
• Écrire la demi-équation chimique ayant lieu au niveau de la lame d'acier. La concentration des ions zinc varie-t-elle au cours de l'électrozincage ?
• Déterminer la quantité d'électricité Q ayant circulé dans le circuit pendant l'électrolyse. En déduire la quantité de matière n(e-) d'électrons échangés.
• Calculer la quantité de matière n(Zn) et la masse m(théo) de zinc déposé théoriquement sur la surface d'acier.
• Calculer la valeur du rendement de l'électrolyse $ r = \dfrac {m'}{m_{théo}}$.
• La masse volumique du zinc est : ρ = 7134 kg.m-3. Estimer l'épaisseur e de la couche de zinc déposé sur la pièce d'acier.
• La réaction est spontanée et totale. Expliquer pourquoi on dit que la couche de zinc protège le fer contre la corrosion.
COURS
C1. Passage forcé d'un courant.
C11. Evolution spontanée.
|
Suivons l'évolution d'un système chimique composé des quatre espèces constituant les 2 couples oxydant réducteur $\bf I_{2(aq)} / I^{-}_{2(g)}$ et $\bf Zn^{2+}_{(aq)} / Zn_{(s)}$. Pour cela dans un bécher, on mélange le même volume V = 20 mL et solutions aqueuses de concentration quantité de matière identique c = 0,015 mol.L-1 : une solution de diode I2(aq), une solution d'iodure de potassium $\left ( K^{+}_{(aq)} ; I^{-}_{(aq)} \right ) $ , une solution de sulfate de zinc $\left ( Zn^{2+}_{(aq)} ; SO^{2-}_{4(aq)} \right ) $. On ajoute ensuite 20 mg de poudre de zinc dans le bécher. |
 |
La concentration initiale en quantité de matière de chaque espèce en solution est :
$\left [ Zn^{2+}_{(aq)} \right ] _{i} = \left [ I_{2(aq)} \right ] _{i} = \left [ I^{-}_{(aq)} \right ] _{i} = \dfrac {n_{i}}{V_{total}} = \dfrac {cV}{V_{total}}=5,0.10^{-5} mol.L^{-1} $
Après quelques minutes, la solution a perdu de sa couleur et devient quasiment incolore, du zinc a disparu.
L'équation de la réaction s'écrit : $ Zn_{s} + I_{2(aq)} \longrightarrow Zn^{2+}_{(aq)} + 2 I^{-}_{(aq)}$.
La constante d'équilibre à 25°C est : K = 1046.
Initialement, le quotient de réaction est donc : $ Q_{r,i}=\dfrac {\left [ Zn^{2+}_{(aq)} \right ] _{i} \times \left [ I^{-}_{(aq)} \right ] _{i} ^{2}}{\left [ I_{2(aq)} \right ] _{i}} =2,5.10^{-5}<K$
Le système évolue donc dans le sens direct jusqu’à atteindre l'état d'équilibre.
C12. Evolution Forcée.
|
En introduisant le système précédent dans un tube en U, en insérant des électrodes de graphite reliées à un générateur de tension continue à chaque ouverture, on pourra forcer le système à évoluer dans le sens opposé à son sens d'évolution spontané.
On observe un dépôt de zinc sur l'électrode reliée à la borne négative du générateur, et à l'autre borne, le mélange prend une teinte orangée (diiode). |
 |
Explication :
- Les électrons libérés à la borne négative sont captés par les ions $Zn^{2+}_{(aq)}$ et se transforment en zinc métallique :
$Zn^{2+}_{(aq)} + 2 e^{-} \overrightarrow{\longleftarrow} Zn_{(s)}$
- Les électrons entrant à la borne positive sont libérés par les ions iodure $I^{-}_{(aq)}$ :
$2 I^{-}_{(aq)} \overrightarrow{\longleftarrow} I_{2(aq)}+ 2e^{-}$
Le système évolue dans le sens opposé à celui observé précédemment :
$Zn^{2+}_{(aq)} + 2 I^{-}_{(aq)} \longrightarrow Zn_{(s)}+I_{2(aq)}$
C2. Electrolyse.
C21. Description.
L'électrolyse est un procédé électrochimique en cours duquel une réaction d'oxydoréduction et forcé grâce à un générateur électrique : elle évolue dans le sens contraire au sens d'évolution spontanée.
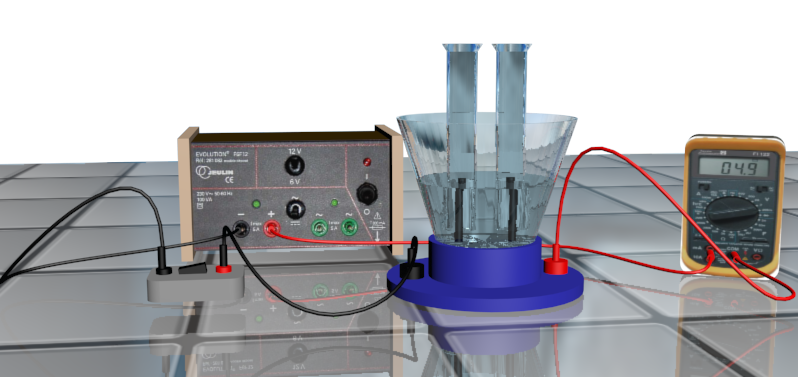
Au laboratoire, l'électrolyse est réalisée dans un électrolyseur qui forme un dipôle électrique récepteur.
L'électrolyseur est formé d'une cuve dans laquelle on verse une solution électrolytique (électrolyte).
Deux électrodes, faites d'un matériau inerte chimiquement, ou d'un métal participant à la réaction d'oxydoréduction, baignent dans cette solution et sont reliées aux bornes d'un générateur électrique.
|
L'électrode reliée au pôle négatif du générateur fournit les électrons nécessaires à la réduction : $Zn^{2+}_{(aq)} + 2 e^{-} \overrightarrow{\longleftarrow} Zn_{(s)}$ .
A l'électrode reliée au pôle positif du générateur fournit les électrons : $2 I^{-}_{(aq)} \overrightarrow{\longleftarrow} I_{2(aq)}+ 2e^{-}$ |
C22. Etude quantitative de l'électrolyse.
L'électrolyse dure tant que le générateur électrique fonctionne jusqu'à disparition du réactif limitant.
La quantité d'électricité échangé dépendant de l'intensité I et de la durée Δt de l'électrolyse.
La quantité de charges électriques q est :
|
q : charge électrique en coulombs (C) I : intensité électrique en Ampères (A) Δt : durée de l'électrolyse en seconde (s) |
Cette quantité de charges électriques est liée à la quantité de matière d'électrons échangés lors de l'électrolyse :
|
n(e-) : quantité de matière d'électrons en mole (mol) NA : constante d'Avogadro e : charge élémentaire en coulomb (1,6.10-19 C) |
Exemple : Dans le cas de l'étude considérée précédemment, pour une intensité I = 500 mA.
$Zn^{2+}_{(aq)} + 2 e^{-} \overrightarrow{\longleftarrow} Zn_{(s)}$
$2 I^{-}_{(aq)} \overrightarrow{\longleftarrow} I_{2(aq)}+ 2e^{-}$
A l'anode (oxydation) : $ n \left ( I_{2formé} \right )=\frac {1}{2} n \left ( I^{-}_{consommé} \right )= \frac{1}{2} n\left ( e^{-} \right) =\frac {I\times \Delta t}{2 \times N_{A}\times e}$
A la cathode (réduction) : $ n \left ( Zn_{formé} \right )= n \left ( Zn^{2+}_{consommé} \right )= \frac {1}{2} n\left ( e^{-} \right)=\frac {I\times \Delta t}{2 \times N_{A}\times e}$
Bilan :
$ n \left ( I_{2formé} \right )=n \left ( Zn_{formé} \right )=1,6.10^{-3}mol $
$ n \left ( I^{-}_{consommé} \right ) = 3,2.10^{-3} mol$
et
$ n \left ( Zn^{2+}_{consommé} \right )=1,6.10^{-3}mol $
C3. Stockage et conversion de l'énergie chimique.
Le stockage de l'énergie consiste à préserver les quantités d'énergie pour une utilisation future. Il est au cœur des enjeux actuels, qu'il s'agisse d'optimiser les ressources énergétiques où d'en favoriser l'accès. Le stockage permet d'ajuster la production et la consommation d'énergie.
La diminution des réserves d'hydrocarbures, l'offre grandissante des appareils nomades, les problèmes liés à la pollution et au réchauffement climatique, pousse les chercheurs à développer des dispositifs dans lesquels s'effectue une conversion d'énergie chimique en énergie électrique.
C31. Les piles.
|
Une pile est un dispositif chimique qui convertit l'énergie chimique en énergie électrique grâce à une réaction d'oxydoréduction spontanée (une fois le circuit électrique fermé). |
 |
|
A lélectrode de manganèse : $ 2 MnO_{2} + 2 H_{2}O+2e^{-} \overrightarrow{\longleftarrow} 2 MnOOH + 2 HO^{-} $
A celle de zinc : $ Zn + 2 HO^{-} \overrightarrow{\longleftarrow} ZnO + H_{2}O + 2 e^{-}$ |
 |
C32. Les accumulateurs.
|
Un accumulateur est un système électrochimique qui agit comme un dispositif de stockage d'énergie électrique sous forme chimique. Il peut fonctionner suivant deux modes :
|
 |
C33. Processus biochimique de stockage.

La transformation du dioxyde de carbone et de l'eau n'est pas spontanée.
Les végétaux chlorophylliens transforment eux-mêmes de la matière organique et de consommer du dioxyde de carbone.
Ajouter un commentaire