Méthodes Chimiques d'Analyse
ACTIVITES
A1 : Préparer une solution.
Comment préparer pour un TP une solution à une concentration donnée en utilisant les données inscrites sur un flacon ?
|
|
|
|
Préparation :
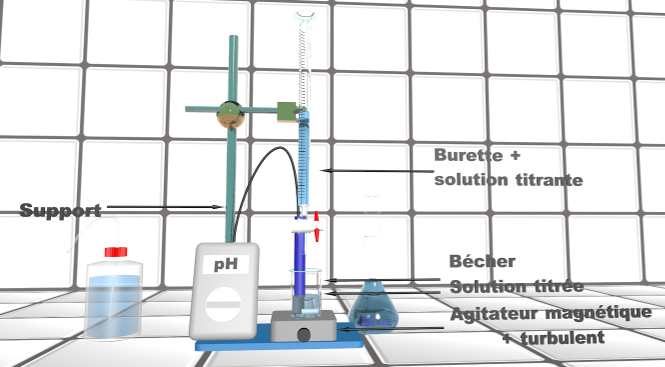
• Sur la situation ci-dessus, lister le matériel présent. Quel matériel absolument nécessaire n'y apparaît pas ?
• Identifier les icônes présentes sur le flacon d'acide. Où doit s'effectuer cette manipulation ?
Calculs nécessaires :
• Déterminer la masse d'un litre de solution commerciale.
• Quelle masse de soluté contient-elle ?
• Déterminer sa concentration c en quantité de matière de soluté.
Manipulations :
• Visionner l'animation fournie.
• Etablir le protocole pour préparer une solution en quantité de matière c0 = 2,0×10-1 mol.L-1.
A2 : Titrage par suivi pH-métrique.
La valeur indiquée est-elle juste ?
A21. Approche expérimentale.
|
|
• Effectuer les calculs nécessaires pour déterminer la concentration en quantité de matière supposée.
A22. Manipulation.
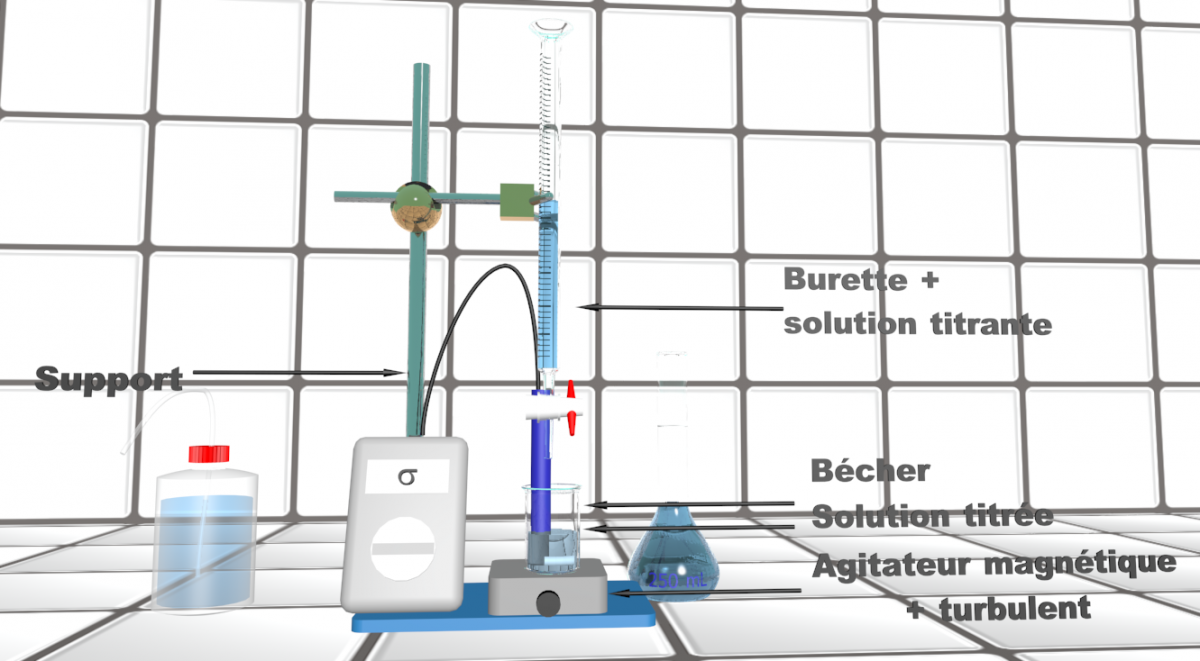
|
Doc5 : schéma du montage. |
|
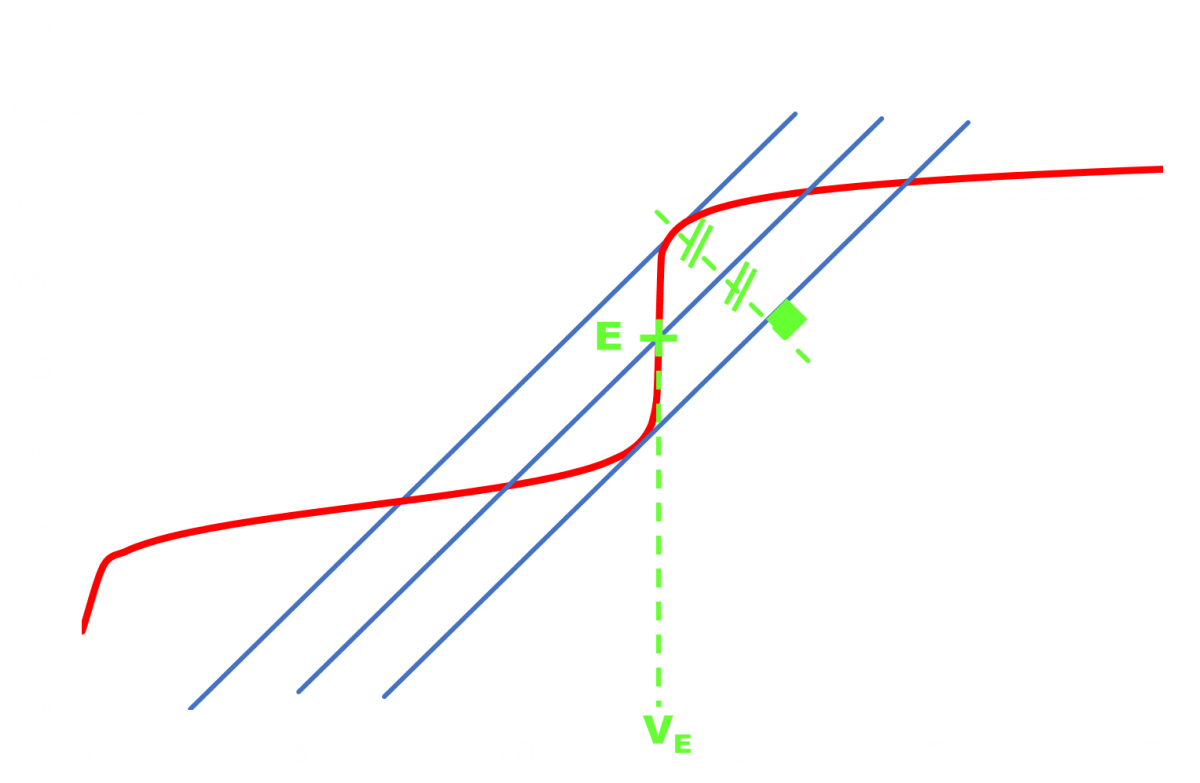
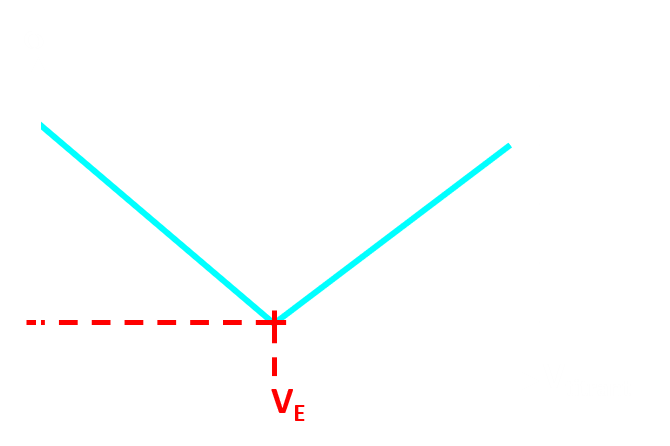
Doc6 : Repérer l'équivalence.
NB : le volume équivalent peut aussi être repérer en observant le changement de couleur d'un indicateur coloré approprié. |
• A votre disposition : le vinaigre et une solution de soude à c0 = 1,0 mol.L-1. Proposer un protocole pour vérifier la valeur indiquée en listant le matériel nécessaire.
• Une fois le protocole valider, le mettre en œuvre.
• Présenter les résultats dans un compte rendu précis.
• Conclure quant à la valeur indiquée.
A23. Simulations informatiques.
A23a. Evolution des quantités de matière.
Le programme ci-dessous permet de simuler les quantités de matières présentes au cours du titrage.
Modifier les données afin de vérifier les résultats obtenus lors de la manipulation
Evolution des différentes quantités de matière en fonction du volume de soude versé.
(effectuer un copier-coller des lignes ci-dessous pour les introduire dans Py.scripter)
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 |
# -*- coding: utf-8 -*- from matplotlib import* from numpy import* from pylab import * d=8 ####degré du vinaigre f1=10 ####facteur de dilution vinaigre cvin=d*10/(60*f1) ####concentration en acide après dilution cOH=0.1 ####concentration soude vvin=10 ####volume initial de solution ve=cvin*vvin/cOH ####volume équivalent ############avant équivalence###################### abscisse1=linspace(0,ve,ve*10+1) ######axe abscisses avant eq nacide1=(cvin*vvin-cOH*abscisse1)*1e-3 ####qté en acide avant éq plt.plot(abscisse1,nacide1,color="blue",label="AH") ####tracé qté en acide avant éq nbase1=cOH*abscisse1*1e-3 ####qté en base avant éq plt.plot(abscisse1,nbase1,color="green",label="A-") ####tracé qté en base avt éq nOH1=0*abscisse1 ####qté en soude avant éq plt.plot(abscisse1,nOH1,color="red",label="HO-") ####tracé qté en acide OH- avt éq ############après équivalence###################### abscisse2=linspace(ve,25,(25-ve)*10+1) ######axe abscisses apres eq nacide2=0*abscisse2 ####qté en acide après éq plt.plot(abscisse2,nacide2,color="blue") ####tracé qté en acide après éq nbase2=cvin*vvin*1e-3+0*abscisse2 ####qté en base après éq plt.plot(abscisse2,nbase2,color="green") ####tracé qté en base après éq nOH2=cOH*(abscisse2-ve)*1e-3 ####qté en soude avant éq plt.plot(abscisse2,nOH2,color="red") ####tracé qté en acide OH- après éq ############# graphique############################ plt.title("Evolution des quantités de matière des espèces en fonction du volume de soude versée \nTitrage de l'acide acétique par la soude") plt.legend(loc="upper right") xlabel=("Volume de soude (en mL)") ylabel=("Quantités de matière des espèces en solution (en mol)") plt.grid() plt.show() |
A23b. Evolution du pH.
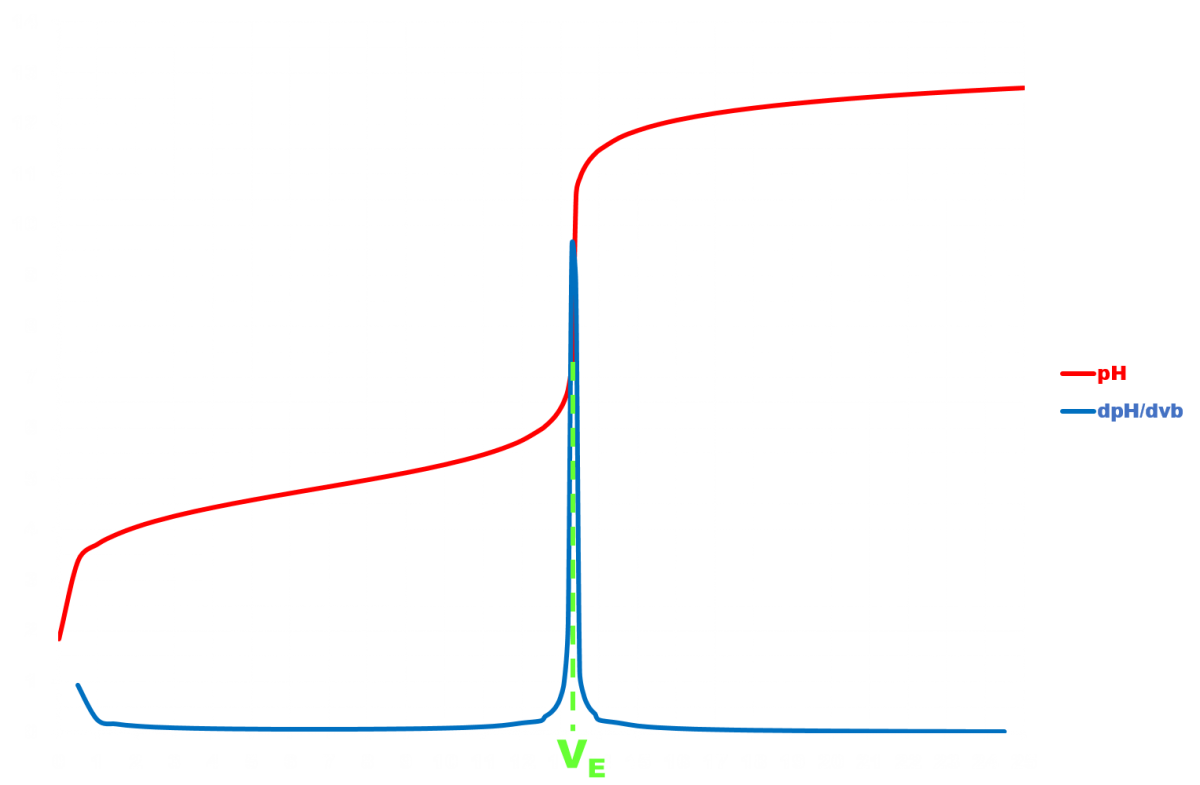
Le programme ci-dessous permet de simuler la variation du pH au cours du titrage.
Modifier les données afin de vérifier les résultats obtenus lors de la manipulation
Evolution du pH en fonction du volume de soude versé.
(effectuer un copier-coller des lignes ci-dessous pour les introduire dans Py.scripter)
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 |
# -*- coding: utf-8 -*- from matplotlib import* from numpy import* from pylab import * d=8 ####degré du vinaigre f1=10 ####facteur de dilution vinaigre cvin=d*10/(60*f1) ####concentration en acide après dilution cOH=0.1 ####concentration soude vvin=10 ####volume initial de solution ve=cvin*vvin/cOH ####volume équivalent pKa=4.76 DpH1=[0] ####liste pH avant éq DpH2=[0] ####liste pH avantaprès##### ############avant équivalence###################### abscisse1=linspace(0,ve,ve*100+1) ######axe abscisses avant eq pH1=pKa+log10(cOH*abscisse1/(cvin*vvin-cOH*abscisse1)) ######pH après eq plt.plot(abscisse1,pH1,color="blue",label="pH") ######Tracé pH après eq for i in range(0,len(abscisse1)-1): ######Liste dpH/dv avant éq DpH1.append(0.5*(pH1[i+1]-pH1[i])/(abscisse1[i+1]-abscisse1[i])) plt.plot(abscisse1,DpH1,color="red",label="dpH/dV") ######tracé dpH/dV avant éq ############après équivalence###################### abscisse2=linspace(ve,25,(25-ve)*100+1) ######axe abscisses après eq pH2=14+log10(cOH*(abscisse2-ve)/abscisse2) ######pH après eq plt.plot(abscisse2,pH2,color="blue") ######Tracé pH après eq for i in range(0,len(abscisse2)-1): ######Liste dpH/dv après éq DpH2.append(0.5*(pH1[i+1]-pH1[i])/(abscisse1[i+1]-abscisse1[i])) plt.plot(abscisse2,DpH2,color="red") ######tracé dpH2/dV après éq ############# graphique############################ plt.title("Evolution du pH et variation du pH en fonction du volume de soude versée") plt.legend(loc="upper right") xlabel=("Volume de soude (en mL)") ylabel=("Quantités de matière des espèces en solution (en mol)") plt.grid() plt.show() |
A3 : Titrage par suivi conductimétrique.
A31. Interprétation de la valeur indiquée.
• Interpréter cette valeur.
• Traduire cette valeur en concentration(s) molaire(s).
A32. Mannipulations.
|
|
• Dresser le tableau d'avancement correspondant à la réaction support.
• Donner l'expression de la conductivité de la solution dans le bécher lors du dosage.
• Doser 100 mL de cette solution en versant la solution titrante mL par mL. Noter les valeurs obtenues et tracer les variations de la conductivité s en fonction du volume v de solution titrante versée.
• Représenter la courbe σ? = f(v).
• Déterminer alors la valeur cherchée et comparer à l'indication.
Exercices : 13, 14, 16, 18, 19, 20, 22, 23, 31, 33, 38 P75 à 85
COURS
C1 : Caractéristiques d'une solution aqueuse.
C11 : Titre massique.
C12 : Densité.
C12a : Masse volumique.
|
Comme son nom l'indique, la masse volumique d'un corps est le rapport d'une masse de ce corps au volume correspondant :
|
C12a : Masse volumique.
|
La densité d'un corps permet de comparer sa masse volumique à celle de l'eau, les deux masses volumiques étant exprimées dans la même unité
NB : ρ?eau = 1000 kg.m-3 |
C13 : Préparer une solution diluée.
C13a : Concentration molaire de la solution mère.
|
Considérant une solution mère de taux massique t, de densité d et de volume V, sa concentration molaire est :
|
C13b : Concentration molaire d'une solution diluée.
C2 : Principe du titrage.
• Le titrage consiste à suivre l'évolution d'une grandeur physique (pH, conductivité) d'une solution lors d'une réaction chimique rapide.
• On fait réagir l'espèce d'une solution dont on ne connaît pas la concentration (solution titrée) avec un réactif en solution dont on connaît la concentration (solution titrante).
• Il sert à déterminer la concentration inconnue.
• A un certain point de la réaction, le produit titré aura totalement disparu (point équivalent). A ce point, les quantités de matières sont toutes les deux nulles (conditions stoechiométriques).
Dans ces conditions, la quantité de titré est calculée grâce à l'équation de la réaction.
Pour la réaction : $aA + bB \longrightarrow cC+ dD $
| Equation chimique |
$aA + bB \longrightarrow cC+ dD $ |
|||||
| Etat | Avct(mol) | Quantités de matière (mol) | ||||
| Initial | x = 0 | niA | niB | 0 | 0 | |
| intermédiaire | x | niA -ax | niA? -bx | cx | dx | |
| Final | x = xf | niA -axf | niA? -bxf | cxf | dxf | |
A l'équivalence (conditions stoechiométriques) : $\dfrac {n_a}{a} = \dfrac {n_b}{b} \Leftrightarrow \dfrac {c_{a}\times V_{a}}{a} = \dfrac{c_{b}\times V_{b}}{b}$
Si l'espèce A est l'espèce titrée, on a donc : $c_{a}=\dfrac {a \times c_b\times V_{b}}{V_{a}\times b}$
• Connaissant la concentration du titrant, on pourra en déduire la quantité de matière du titrant ayant réagi et ainsi, en déduire la quantité de titré et ainsi sa concentration.
C5. Conclusion.
On mesure une grandeur physique (pH, absorbance, conductivité…) dans un milieu siège d'une réaction rapide.
Cette grandeur varie au cours de la réaction chimique.
La loi de variation de cette grandeur permet d'évaluer sa valeur à un instant donné, et particulièrement de la connaître dans les conditions stoechiométriques.
Par l'intermédiaire de l'écriture de la réaction chimique, on peut alors déterminer la quantité ou la concentration du réactif inconnu.
Ajouter un commentaire