Méthodes Physiques d'Analyse
ACTIVITES
A1 : Calcul du pH d'une solution.
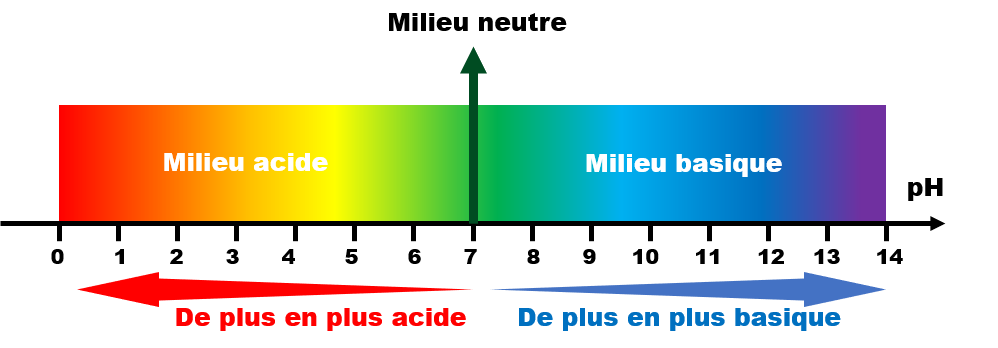
L’acidité d’une solution dépend de sa concentration en quantité de matière d’ions oxonium H3O+.
Peut-on établir une relation mathématique entre ces différentes grandeurs ?
|
Doc1 : matériel |
|
|
Vous choisirez une des trois démarches suivantes afin de répondre à la problématique.
A11 : Démarche experte.
Elaborer un protocole expérimental permettant de tester la relation entre le pH et la concentration en quantité de matière d’ions oxonium d’une solution. Réaliser.
A12 : Démarche avancée.
A121. Mesurer les pH d’une gamme de solutions obtenues par dilutions successives de la solution mère (doc.3)
A122a. Tracer un graphique permettant de tester la relation mathématique donnée dans le doc2.
A122b. En déduire le domaine de validité de la relation donnant le pH.
A13 : Elementaire.
A131. Dilution.
A131a. Réaliser, par dilution d'un facteur 10 de la solution mère, une solution d’acide chlorhydrique de concentration 10-2 mol.L-1 (voir geste expérimental).
A131b. Répéter cette opération pour obtenir une gamme de solutions jusqu’à 10-8 mol.L-1.En déduire le domaine de validité de la relation donnant le pH.
A131c. Mesurer le pH de ces solutions.
A132. Exploitation.
A131a. Tracer le graphique représentant le pH des solutions en fonction de l’opposé du logarithme de leur concentration.
A131b. Repérer les valeurs de concentration pour lesquelles la relation du doc2 est vérifiée, puis en déduire le domaine de validité de cette relation..
A2 : Dosage par étalonnage conductimétrique.
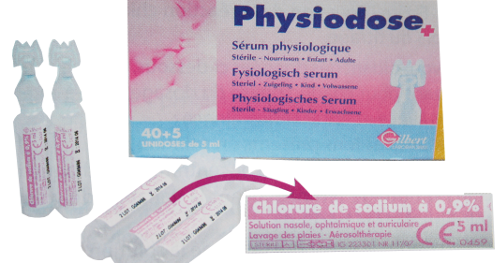
Le sérum physiologique est une solution pharmaceutique utilisée pour nettoyer le nez, les yeux, etc…
Elle contient de l'eau et du chlorure de sodium. Le pourcentage indiqué est un pourcentage massique.
Objectif : vérifier la valeur indiquée par étalonnage conductimétrique .
|
Doc 1 : Caractéristiques d'un sérum physiologique.
|
|
Doc 2 : Protocole.
|
|
|
A21. Préparation.
• Interpréter la valeur indiquée sur chaque flacon.
• Traduire cette valeur en concentration(s) molaire(s).
• On ne dosera pas le sérum lui-même, mais une solution obtenue par dilution du sérum d’un facteur 20. Donner deux raisons à ce choix.
• Rédiger le protocole expérimental de dilution du sérum, puis réaliser la dilution.
A22. Dosage par étalonnage.
• Réaliser le dosage conformément au protocole doc 2.
• En déduire la concentration en masse du sérum physiologique.
• Compte tenu de la précision de la concentration en masse donnée dans le doc 1, peut-on utiliser cette solution ?
A23. Lien avec la loi de Kohlrausch.
• Ecrire la relation liant la conductivité de la solution en fonction des conductivités molaires ioniques $\lambda_{Na^{+}}$ et $\lambda_{Cl^{-}}$ et de leurs concentrations molaires respectives $\left [ Na^{+} \right ] et \left [ Cl^{-} \right ]$
• Ecrire la relation liant la conductivité de la solution en fonction des conductivités molaires ioniques $\lambda_{Na^{+}}$ et $\lambda_{Cl^{-}}$ et de sa concentration.
• En déduire que la courbe obtenue doit être une droite linéaire. Quel doit être son coefficient directeur ?
• D'après vos mesures, tracer cette droite et vérifier l'affirmation précédente.
• Toujours d'après vos mesures, déterminer avec plus de précision la concentration de la solution du sérum physiologique.
A3. Spectroscopie infrarouge.
Cette méthode d’analyse permet-elle de conclure quant à la qualité du contenu des deux bouteilles ?
|
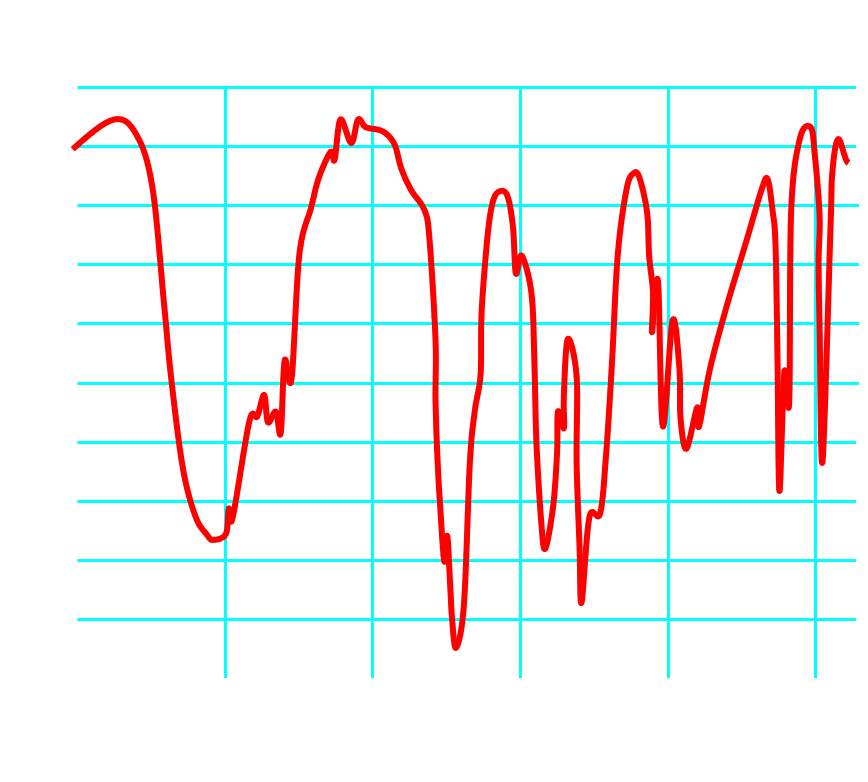
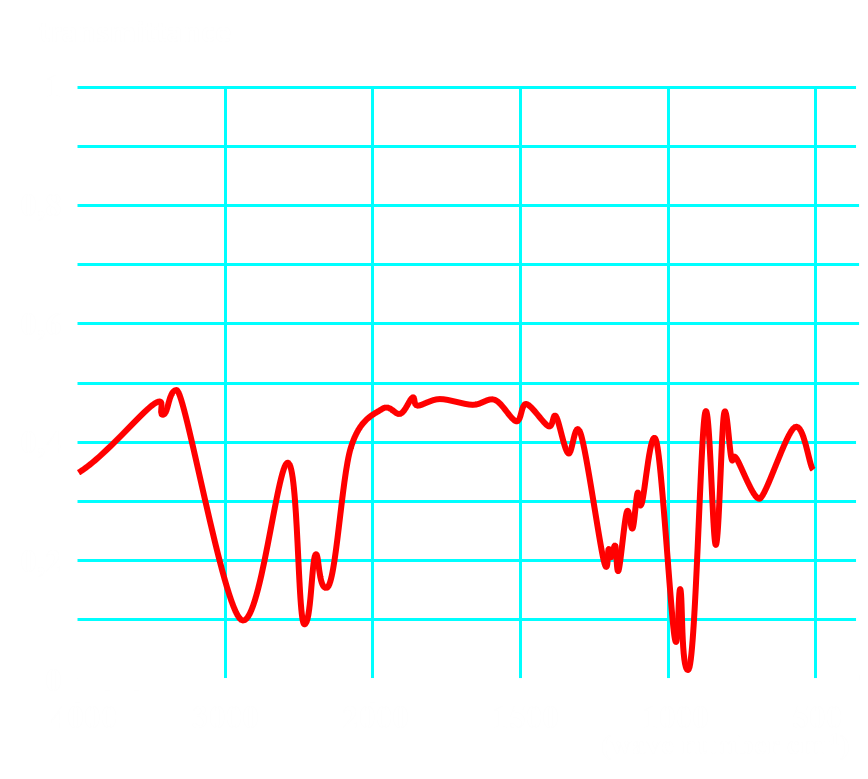
Doc1 : Spectres Infrarouges.
|
|
Doc3 : Spectroscopie infrarouge La spectroscopie infrarouge (IR), par analyse de la fréquence des ondes électromagnétiques absorbées par un échantillon, permet d'obtenir des informations sur la structure de la matière. Un spectre IR représente la transmittance T en fonction du nombre d'onde $\tilde{\nu}$. Les pics (ou bandes) observées correspondent aux longueurs d'onde absorbées et peuvent être associées, en utilisant des tables, à des groupes d'atomes caractéristiques |
|
Doc4 : Tables des données spectroscopiques.
|
|
Doc5 : Vocabulaire. • Nombre d’onde : inverse de la longueur d’onde • Transmittance : quotient de l’intensité de la radiation transmise par l’intensité de la radiation incidente (T est exprimée en % ou par un nombre compris entre 0 et 1) |
En utilisant les documents fournis, justifier du contenu de chaque bouteille.
Exercices : 10, 12, 15, 16, 19, 20, 21 et 24 pages 51, 52 et 53
COURS
C1 : Le pH d'une solution aqueuse.
C11 : Définition.
|
Le pH d'une solution (potentiel Hydrogène) est un indicateur d'acidité lié à la présence des ions oxonium $\left [ H_{3}O^{+} \right ] $ en mol.L-1 en solution.
• c0 est la concentration standard : c0 = 1 mol.L-1 • le pH se mesure avec un pH-mètre. • le pH augmente si $\left [ H_{3}O^{+} \right ] $ en mol.L-1 diminue et inversement. • le pH permet de déterminer la concentration en ions oxonium :
|
Exemples :
• Pour une solution de concentration en ions oxonium $\left [ H_{3}O^{+} \right ] $ = 0,010 mol.L-1 :
$pH = -log \left (\left [ H_{3}O^{+} \right ] \right )$ = -log(0,010) = 2
• Pour une solution de pH = 8,5, la concentration en ions oxonium est $\left [ H_{3}O^{+} \right ] $ = 10-8,5 = 3,2.10-9 mol.L-1 .
C12 : pH et acidité.
• Le pH est une fonction décroissante du pH.
• Plus le pH est grand, moins l'acidité est importante.
C13: Mesure du pH.
|
Le papier pH permet de déterminer approximativement le pH d'une solution. Il contient des indicateurs colorés de pH dont les couleurs varient en fonction du pH. |
Couleur du BBT selon le pH Un indicateur coloré est une espèce chimique dont la couleur varie selon le pH, sa couleur permet d'évaluer le pH d'une solution. |
 |
Le pH peut être déterminer plus précisément à l'aide d'un pH-mètre étalonné avec des solutions de pH connus. · Pour mesurer le pH d'une solution acide, on l'étalonne avec des solutions tampons à pH = 7 et pH = 4. · Pour mesurer le pH d'une solution basique, on l'étalonne avec des solutions tampons à pH = 7 et pH = 9. |
C2 : Spectroscopie.
C21 : Principe.
Chaque espèce chimique possède des propriétés physiques différentes et réagit différemment lorsqu'elle est soumise à certaines ondes électromagnétiques (UV, visible, IR) en émettant ou absorbant d'autres ondes.
Ces réponses peuvent être analysées à l'aide d'appareils appropriés.
C22 : Spectroscopie UV-Visible.
C22a. Description.
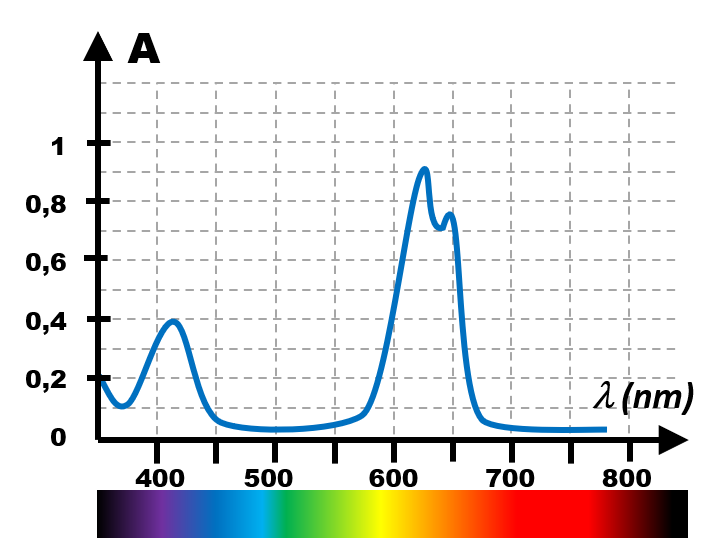 |
Il s'agit d'un graphe, obtenu en soumettant l'espèce étudiée à des ondes UV-Visibles. Il représente l'absorbance de la matière exposée lorsqu'elle est soumise à ces ondes. Cette absorbance augmente proportionnellement avec la concentration (loi de Beer-Lambert).
· On repère la longueur d'onde du maximum d'absorbance en soumettant une solution mère de l'espèce à étudier. · On soumet ensuite différentes solutions diluées de cette solution mère à une onde lumineuse de la longueur d'onde déterminée précédemment. · Il suffit alors d'exposer la solution à étudier pour déterminer la concentration de la matière à étudier.
On parle de dosage par étalonnage. |
|
Solutions étalons de sulfate de cuivre. La couleur bleu/cyan est due aux ions cuivre II qui servent à étalonner le spectrophotomètre. La concentration à déterminer doit se situer dans la gamme des concentrations de ces solutions. |
 |
C22b. Loi de Beer-Lambert.
|
L'absorbance A d'une solution colorée est proportionnelle à la concentration molaire c de l'espèce responsable de sa couleur (loi de Beer-lambert) :
L'absorbance d'une solution est une grandeur additive : si sa couleur est due à plusieurs espèces chimiques, l'absorbance résultante est égale à la somme des absorbances de chaque espèce. $A_{totale} = \sum{A_{i}}=\space\sum{\lambda_{i}\times{c_{i}}}$
|
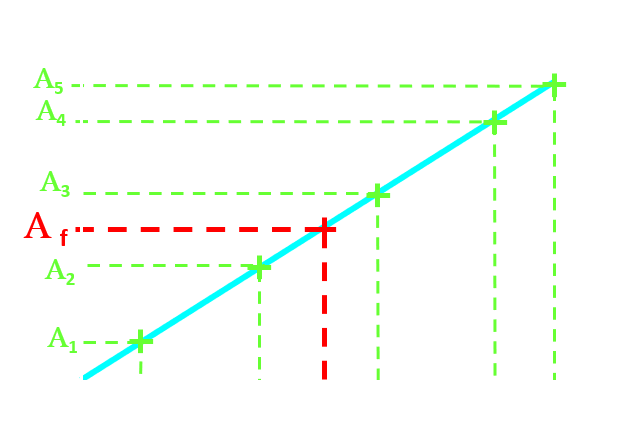 |
L'étalonnage permet de déterminer le coefficient de proportionnalité k (graphiquement ou par analyse de régression linéaire). En mesurant l'absorbance Af de la solution dont on cherche la concentration, on en déduit la concentration cherchée $c_{f}=\frac {A_{f}}{k}$ |
C23 : Spectroscopie Infrarouge.
C23a. Description.
Lorsque des molécules sont soumises à des rayonnements infrarouges (entre 2500 et 25000 nm), les liaisons covalentes se mettent à vibrer différemment.
Les molécules absorbent alors ces rayonnements.
C'est la détection de ces absorptions que mesure l'absorption infrarouge.
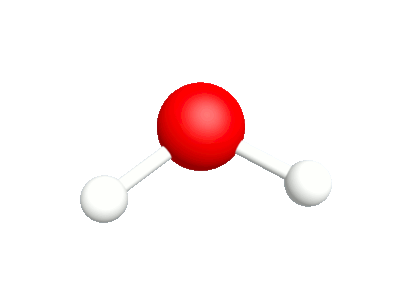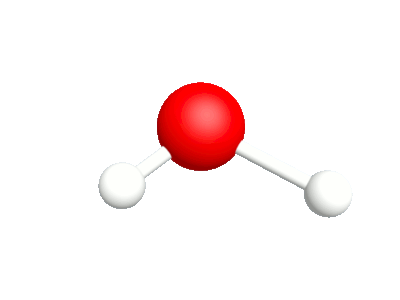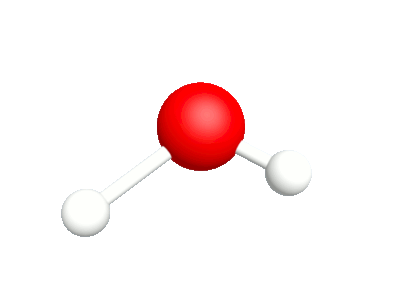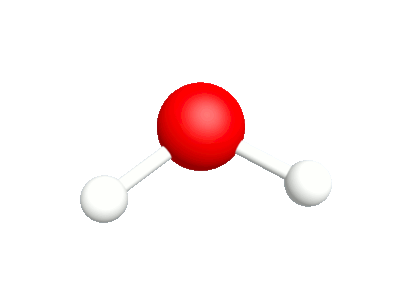
Différents modes vibratoires de la molécule d'eau.
|
1a.Etirement asymétrique Les élongation et compression des liaisons sont en phase |
1b.Etirement symétrique Les élongation et compression des liaisons sont déphasées |
|
2a.Bascule Les rotations autour de l'atome d'oxygène sont en phase
|
2b.Cisaillement Les rotations autour de l'atome d'oxygène sont déphasés |
|
3a.Agitation Les rotations hors du plan sont en phase |
Les rotations hors du plan sont déphasées. |
C23b. Allure d'un spectre IR.
Les spectres IR présentent en général :
Le nombre d'onde $\sigma = \dfrac {1}{\lambda}$ en abscisse, exprimé en cm-1. L'échelle est orientée vers la gauche. Elle n'est pas toujours linéaire.
La transmittance en ordonnée (ou parfois l'absorbance)
Chaque bande d'absorption est associée à un type de liaison, caractérisée par les deux atomes la constituant.
C23c. Exploitation.
|
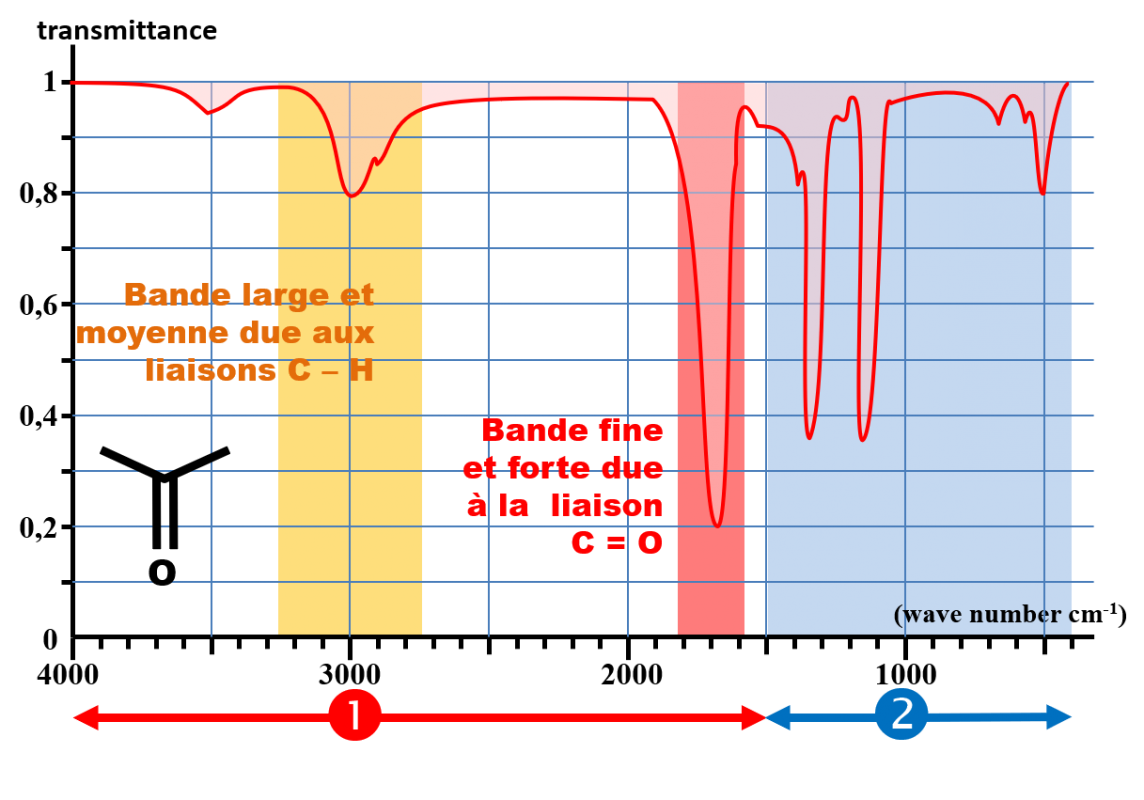
zone 1 Nombre d'onde compris entre 1500 et 4000 cm-1
Cette zone ne contient qu'un nombre limité de bandes, correspondant à des types de liaisons particulier. Chaque bande est caractérisée par :
|
zone 2 Nombre d'onde compris entre 400 et 1500 cm-1
Il s'agit d'une zone très riche en bandes d'absorption pour les molécules organiques possédant plusieurs atomes de carbone. Elle n'est généralement exploitée qu'en comparaison avec un spectre de référence. Cette zone s'appelle l'empreinte digitale de la molécule. |
C23d. Type de liaison.
a) Pour déterminer le type de liaison correspondant à une bande d'absorption :
b) On relève sa position (abscisse).
c) On s'intéresse à sa largeur.
d) On s'intéresse à son intensité.
C23e. Identification de la liaison.
On se reporte à la table des absorptions caractéristiques des liaisons.
| Type de liaison | Nombre d'onde s (cm-1) | Largeur de la bande | Intensité |
| O – H en phase gazeuse | 3500 – 3700 | fine | moyenne |
| O – H en phase condensée | 3200 – 3400 | large | forte |
| N – H en phase gazeuse | 3300 – 3500 | fine | faible |
| N – H en phase condensée | 3100 – 3300 | large | forte |
| C – H | 2900 – 3100 | large | moyenne à forte |
| C = O | 1700 – 1800 | fine | forte |
| C = C | 1500 – 1700 | variable | moyenne à forte |
Table simplifiée (qui n'est pas à connaître)
La spectroscopie IR permet d'identifier la présence de certains types de liaisons au sein d'une molécule.
La plupart du temps, elle permet d'en déduire la nature des groupes caractéristiques de cette molécule.
C3 : Conductimétrie.
C31 : Principe.
• La capacité à conduire le courant électrique est appelée "conductance" (inverse de la résistance).
$G = \dfrac {1}{R} = \dfrac {i}{U} $
G : en siemens (S), R en ohm (W), i en ampère (A), V en volt (V)
|
• Chaque espèce chimique conduit plus ou moins le courant électrique. Chacune possède une conductivité $\sigma$ (proportionnelle à la conductance) qui lui est propre. Elle dépend de la température et de la nature de la solution. $\sigma = \dfrac {l}{S}\times G $ $\sigma$ en Siemens par mètre (S.m-1) $l$ distance entre les électrodes en mètres (m) $S$ surface des électrodes en mètre carré (m2) et G en siemens (S) |
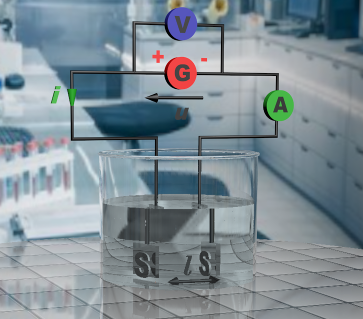 |
|
Loi de Kolrausch · La conductivité d'une solution est la somme des conductivités molaires ioniques λi des différentes espèces la constituant. Plus il y aura d'espèces conductrices, plus sa conductivité sera grande. $\sigma=\sum{\lambda_{i}\times \left [ X_{i}\right ]}$ $\lambda_i$ : conductivité molaire ionique en S.m2.mol-1 $\left [ X_i \right ]$ : concentration volumique molaire en mol.m-3. |
C32. Description.
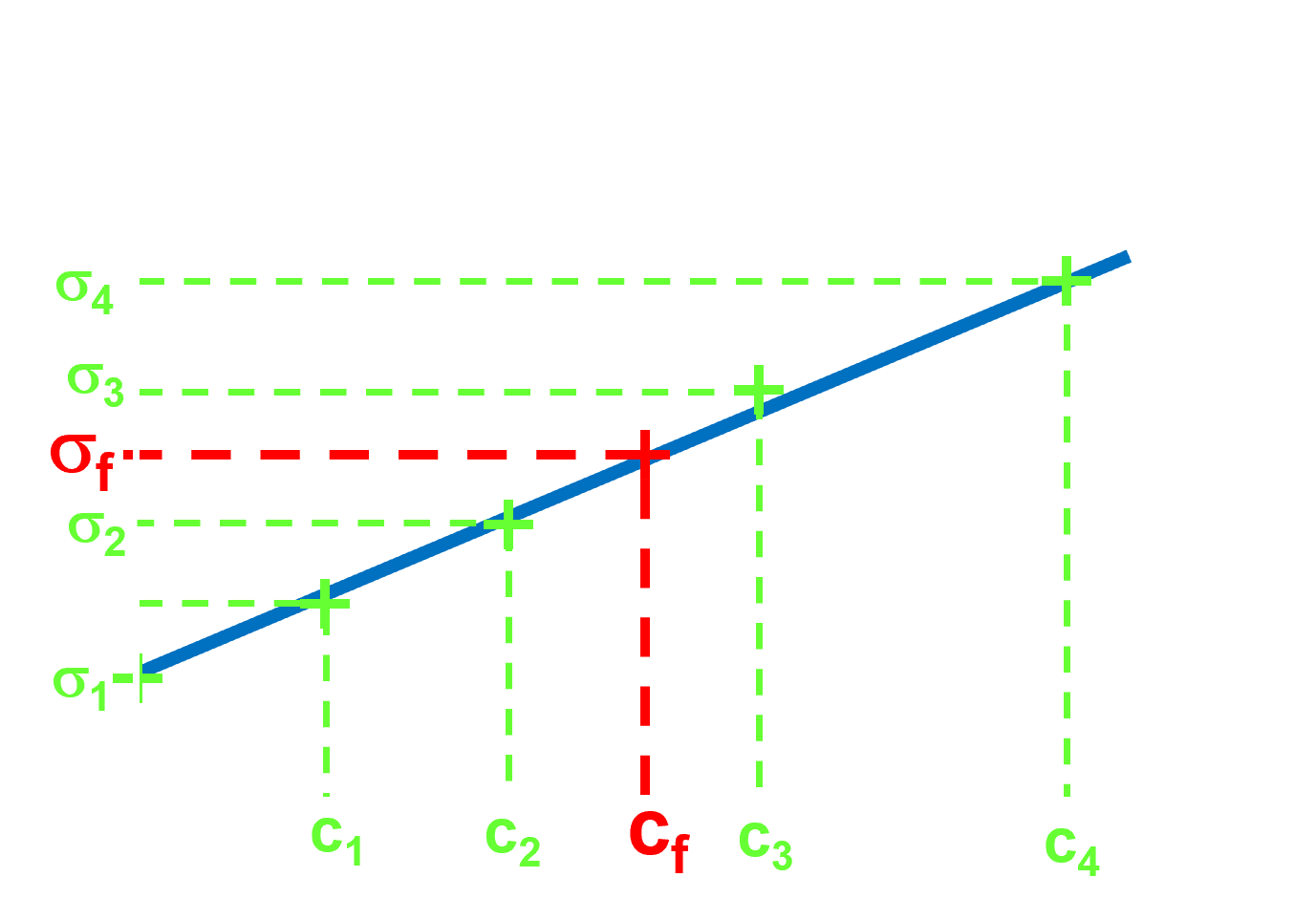 |
• On mesure dispose des différentes solutions de même type que la solution dont on souhaite déterminer la concentration. • On connaît les concentrations de ces solutions. • Il suffit alors de mesurer la conductivité de la solution de concentration inconnue. • L'étalonnage permet alors de déterminer sa concentration. |
C4. Conclusion.
La mesure directe d'une grandeur physique (pH, conductance, absorbance), permet de déterminer la valeur de la grandeur choisie.
Le lien mathématique entre la valeur de la grandeur mesurée et la concentration permet ainsi de connaître la concentration de l'espèce étudiée.
Les spectroscopies IR et spectrophotométriques produites permettent de déterminer les différentes espèces contenues dans le milieu étudié.
Commentaires
-

- 1. Lili Le 31/10/2020
Bonjour serait il possible d’avoir le corrigé de l’activité sur le vin.
Merci
Ajouter un commentaire