Synthèse Organique
ACTIVITES
A1. Formule topologique, nomenclature et isomérie.
|
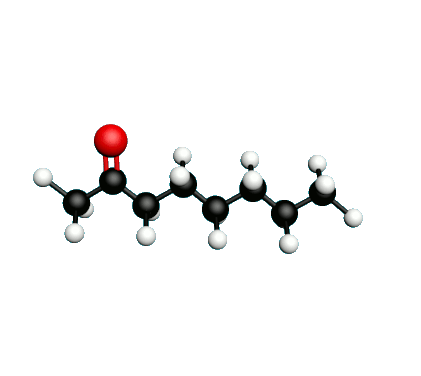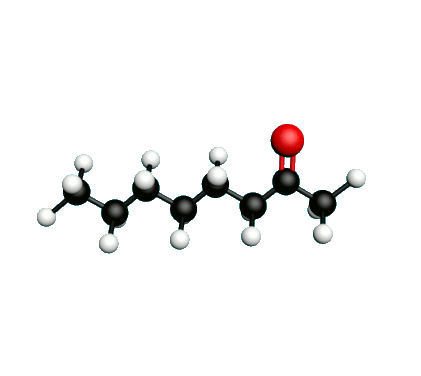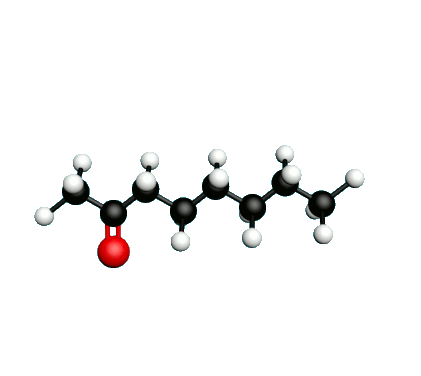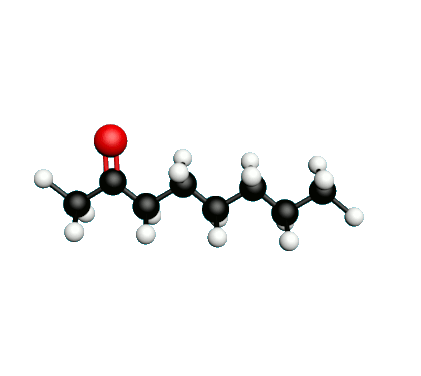
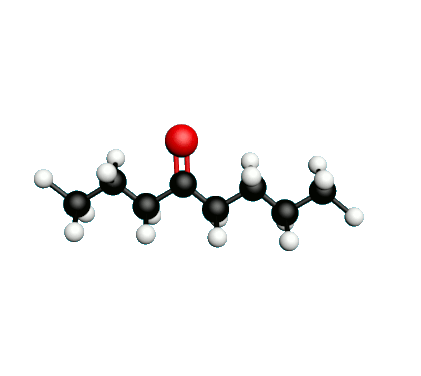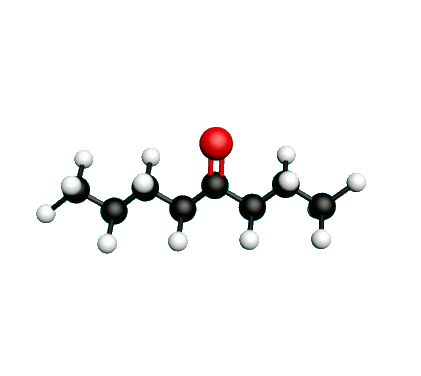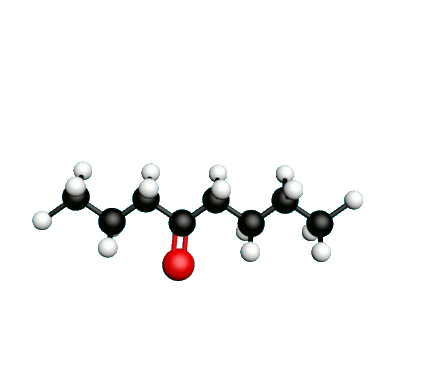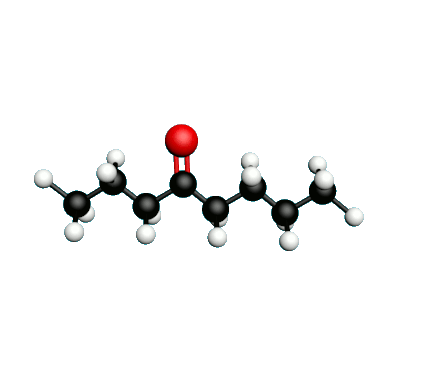
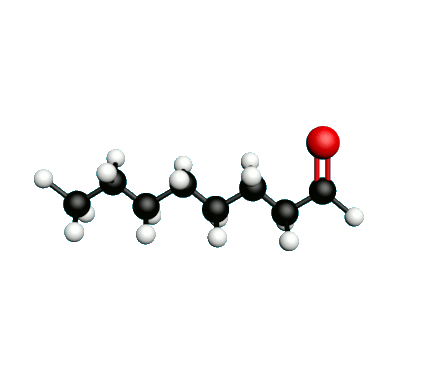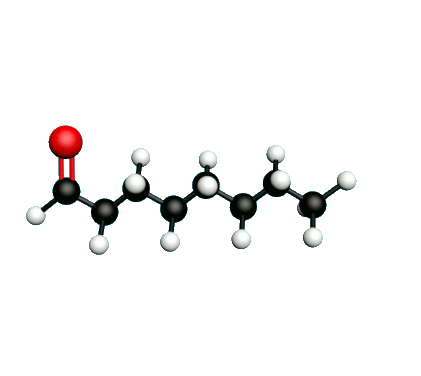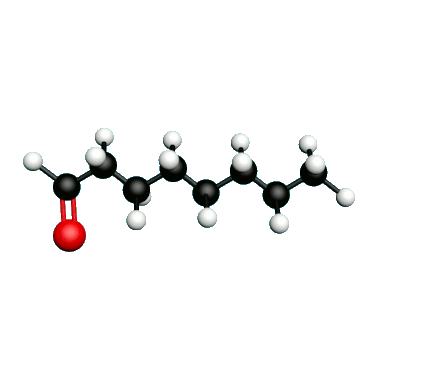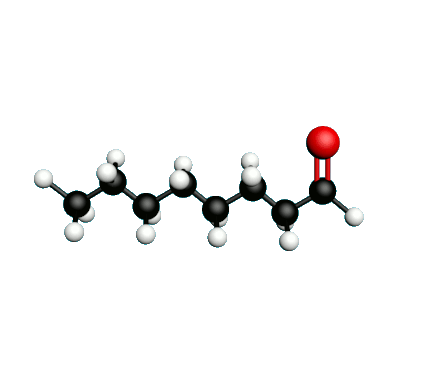
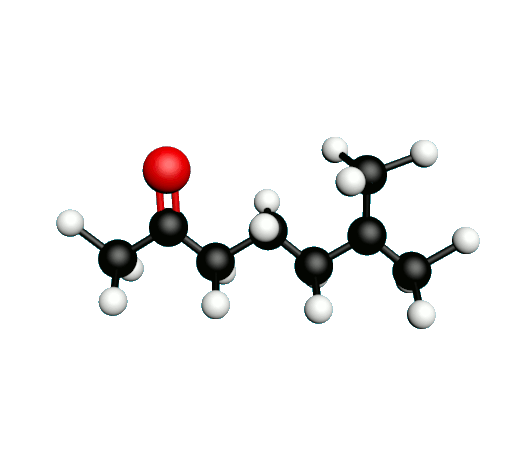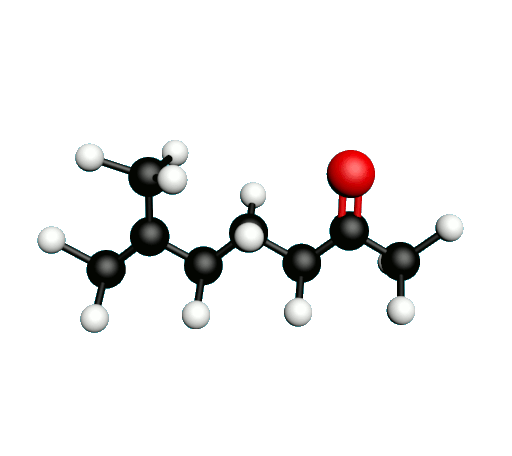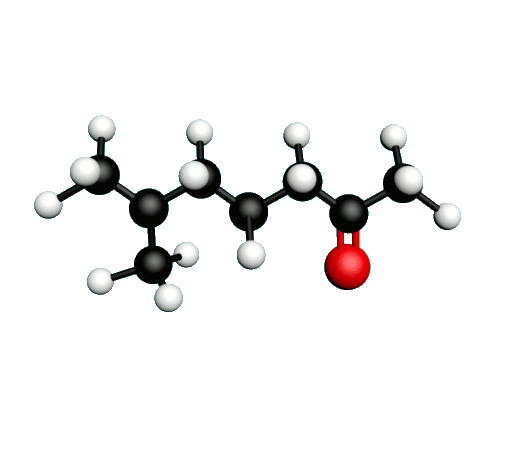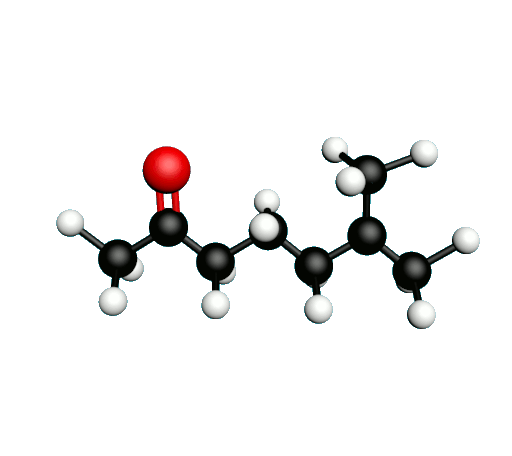
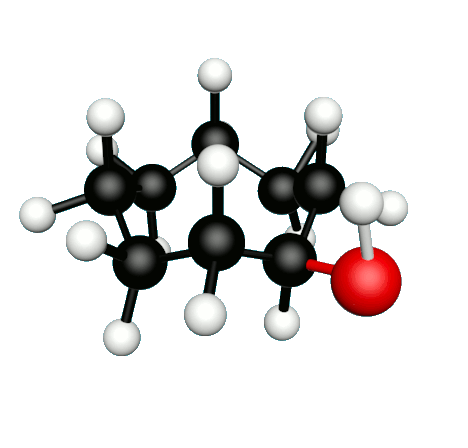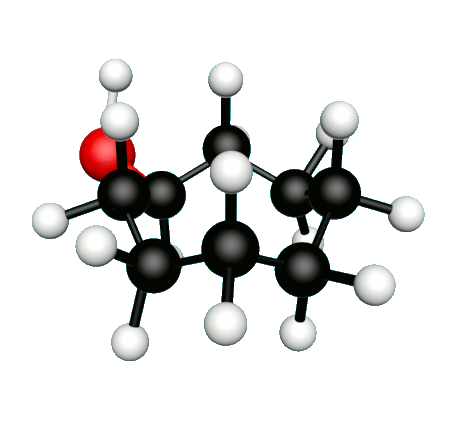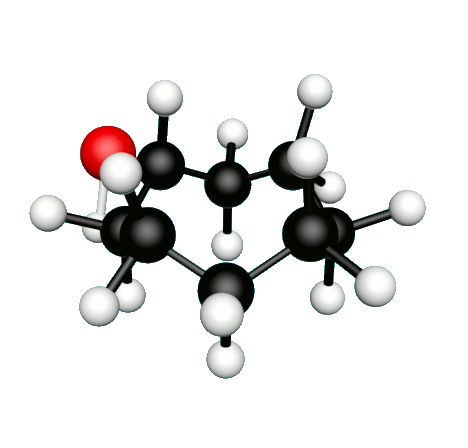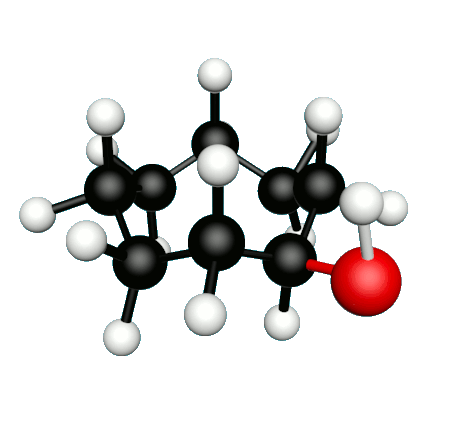
L'octane-2-one est une phéromone d'alarme chez les insectes que l'on synthétise au laboratoire pour l'utilisation en tant que bio insecticide.
|
 |
Comment représenter simplement des molécules qui peuvent être complexes et les nommer ?
|
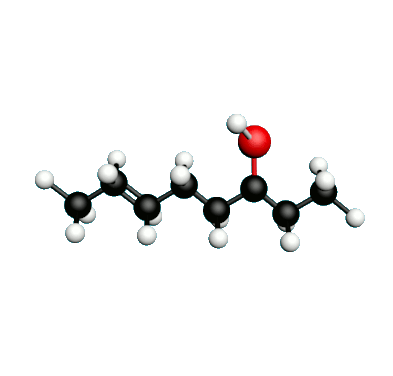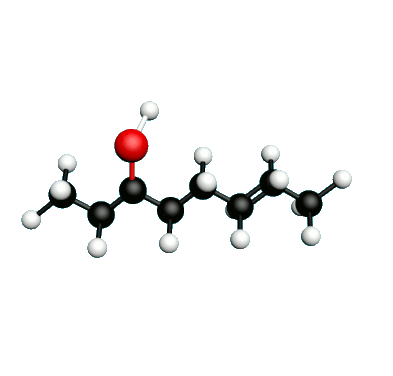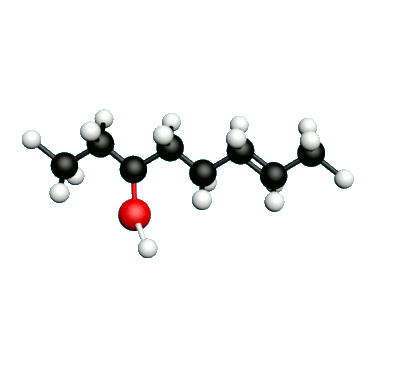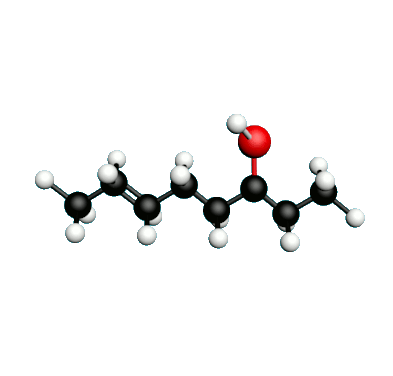
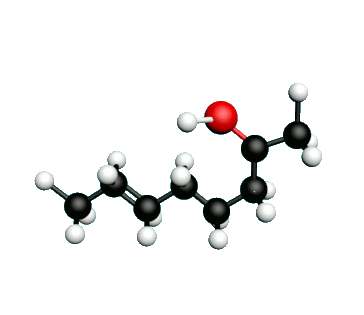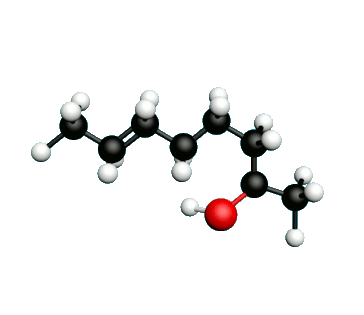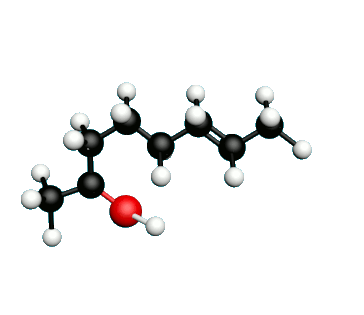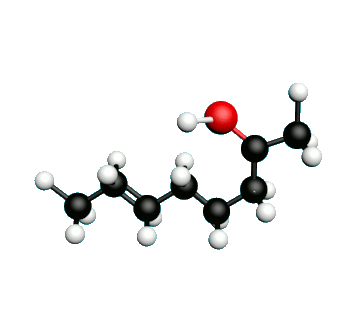
Doc.1 : Modèles moléculaires de l'octan-2-one et de quelques-uns de ses isomères.
|
|
Doc.2 : Définitions. Isomérie de constitution : elle s'applique pour des molécules qui ont la même formule brute, mais des formules semi-développées différentes Isomérie de squelette : les squelettes carbonés des isomères de constitution sont différents Isomérie de position : les isomères ont le même squelette carboné, mais la (les) position(s) des groupes fonctionnels sont différents. Isomérie de fonction : les isomères ont le même squelette carboné mais se différencient par la nature de la (des) fonction(s) chimique(s) portée(s) par la chaîne |
Analyser-raisonner.
• Expliquer à quoi correspondent les segments entre les atomes dans la formule topologique de l’octane-2-one.
• Etablir les formules semi-développées et les formules topologiques des isomères de l’octan-2-one. Tenter de nommer chacun des isomères.
S’approprier.
• Parmi les isomères de l'octan-2-one, identifier les isomères de chaine, de fonction et de position.
• Une chaine carbonée insaturée est une chaine qui possède au moins une liaison multiple entre deux atomes de carbone. Identifier la molécule possédant une chaine carbonée insaturée.
Analyser-raisonner.
• Etablir les règles de représentations des formules topologiques.
• Définir les différentes isoméries.
A2. Polymères.
L'amidon et la cellulose constituent à la fois le tissu végétal aussi l'écorce des arbres sont des polymères naturels. En 1870, les frères John Wesley et Isaiah Hyatt, imprimeurs et inventeurs amateurs, ont aussi réussi après de multiples tentatives à synthétiser l'un des premiers polymères synthétiques à commercialisation industrielle : le celluloïd qui est un substitut à l'ivoire des boules de billard. Depuis, de nombreux polymères synthétiques différents ont vu le jour pour répondre à des contraintes multiples et variées.
Quelle est la structure d'un polymère et comment la représenter ?
Sont-ils naturels ou de synthèse et quelles sont leurs utilisations ?
|
Doc.1 : Formule d'un polymère et motif. Schéma 1 : la polymérisation imagée.
|
|
Doc.2 : Quelques polymères.
|
S’approprier :
• Identifier le motif élémentaire qui se répète dans chacun des polymères du doc.2
Analyser-raisonner :
• Identifier dans le document 2 les polymères naturels et les polymères synthétiques.
• Rechercher au moins deux utilisations des polymères du document 2.
Communiquer :
• Citer des avantages des polymères naturels et/ou biosourcés par rapport aux polymères de synthèse.
Analyser-raisonner :
• Etablir les règles de représentations des formules topologiques. Définir les différentes isoméries.
A3. Optimisation de la vitesse de formation d'un produit et du rendement d'une synthèse.
L’éthanoate de 3-méthylbutyle ou acétate d’isoamyle est utilisé comme agent de saveur. Cette substance est présente naturellement dans la banane. Au laboratoire, on peut la synthétiser en réalisant une transformation limitée entre l’acide éthanoïque et le 3-méthylbutan-1-ol (alcool isoamylique). Or, une synthèse industrielle doit avoir le meilleur rendement possible pour économiser les ressources.
Comment optimiser à la fois la vitesse de formation d’un produit et le rendement de cette synthèse ?
|
Doc.1 : modèle de la synthèse • La synthèse est modélisée par la réaction chimique d'équation :
• L'estérification est une transformation chimique limitée qui est modélisée par un équilibre chimique dont la constante K(T) varie peu avec la température (298 K) et vaut environ 4. |
||||||||
|
Doc.2 : Données.
|
|
Doc.3 : matériel et produits.
|
|
Doc.4 : Protocoles expérimentaux. Trois protocoles vont être menés en parallèle par trois groupes différents afin de dégager l'influence des conditions opératoires sur le rendement. La partie "traitement de la phase réactionnelle et de la récupération de l'ester sera la même selon le protocole.
|
Analyser-raisonner.
• Pour chacun des protocoles réalisés, identifier les facteurs cinétiques qui favorisent la formation de l’acétate d’isoamyle.
• Pour chacun des protocoles réalisés, établir le tableau d’avancement, déterminer le réactif limitant et la masse maximale d’ester que l’on peut théoriquement synthétiser.
Réaliser.
• Expliciter le rendement de la synthèse et le calculer pour chacun des protocoles mis en œuvre.
Analyser-raisonner.
• Comparer les différents protocoles et identifier les différences qui apparaissent entre ceux-ci.
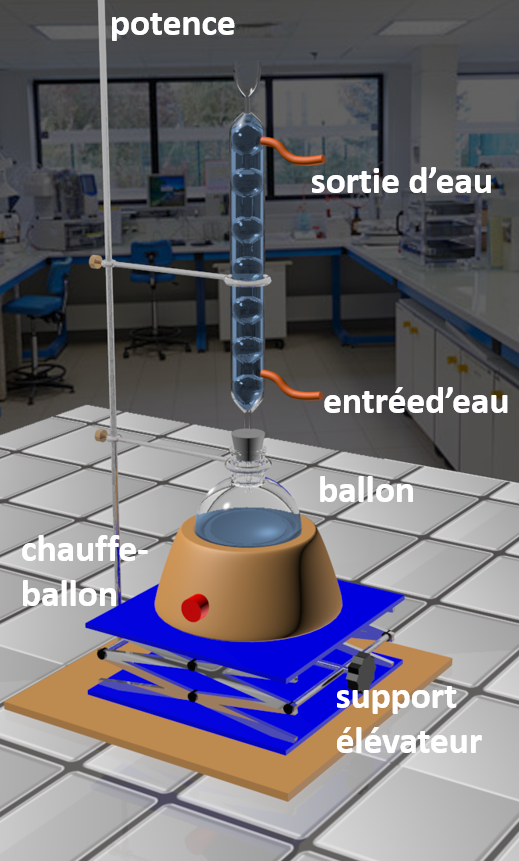
• Expliquer pourquoi un chauffage à reflux est nécessaire pour réaliser cette synthèse et pourquoi on ne peut pas utiliser le montage à distillation fractionnée.
Communiquer.
• Dégager les paramètres qui augmentent le rendement et la vitesse d’une synthèse.
A4. Identifier des réactions de substitution, d'addition ou d'élimination.
Pour synthétiser des molécules, différents types de transformations chimiques sont possibles. Elles sont reconnaissables par les modifications qu’elles apportent à la molécule initiale (le substrat) pour la transformer en la molécule finale attendue (le produit) souhaité.
Quels sont les types de réactions modélisant les transformations chimiques et comment les reconnaitre ?
|
Doc. 1 : Les différents types de réaction en chimie de synthèse.
|
|
Doc.2 : Quelques exemples de réaction en synthèse organique. A : Hémisynthèse de l'aspirine.
|
|
Doc.3 : Synthèse du chlorure de vinyle. La synthèse du chlorure de vinyle met en jeu les deux transformations suivantes : 1. Synthèse du 1,2-dichloroéthane à partir d'éthylène :
2. Synthèse chlorure de vinyle à partir du 1,2-dichloroéthane.
|
Analyser-raisonner.
· A l’aide du doc.1, identifier dans le doc.2 le type de réaction qui modélise les transformations Ⓐ et Ⓑ .
Valider.
· Montrer que durant la synthèse Ⓒ, bien qu’une molécule d’eau soit formée pendant la réaction, cette réaction n’est pas une élimination. Donner son nom.
Réaliser.
· Identifier à quel type de réaction est associée l’hydrogénation de l’acide oléique.
Analyser-raisonner.
· Identifier les deux types de réactions qui permettent d’obtenir le chlorure de vinyle.
Communiquer.
· Donner le nom des types de réactions auxquels le chimiste pourra faire appel et indiquer comment les reconnaître.
A5. Synthèses comparées d'une espèce odorante
Le benzoate de méthyle est des constituants de diverses huiles essentielles d’œillet ou d’ylang-ylang.
Comment améliorer le rendement de sa synthèse au laboratoire ?
|
Doc.1 : Réaction de synthèse.
|
|
|
|
Doc.4 : Quelques données sur les réactifs et produits.
|
REALISER.
· Mettre en œuvre l’expérience A ou l’expérience B.
· Calculer les quantités de matière de chacun des réactifs introduits.
· Représenter l’ampoule à décanter et les deux phases en présence dont on justifiera les positions.
ANALYSER-RAISONNER.
· Pour quelle raison introduit-on de l’eau salée ?
· Quel est le rôle de la solution d’hydrogénocarbonate de sodium introduite ? Ecrire l’équation de la réaction acide-base sachant que les couples intervenants sont :
$CO_{2,(aq)},H_2O / HCO_{3(aq)}^-$ et $C_6H_5CO_2H_{(aq)}/C_6H_5CO_{2(aq)}^-$
Valider.
· Déterminer le rendement de la synthèse réalisée.
Analyser-raisonner.
· De l’étude des rendements comparées des expériences A et B, déduire une méthode permettant d’augmenter le rendement de la synthèse réalisée.
A6. Synthèse conduisant à la modification d'un groupe caractéristique : l'acide benzoïque.
|
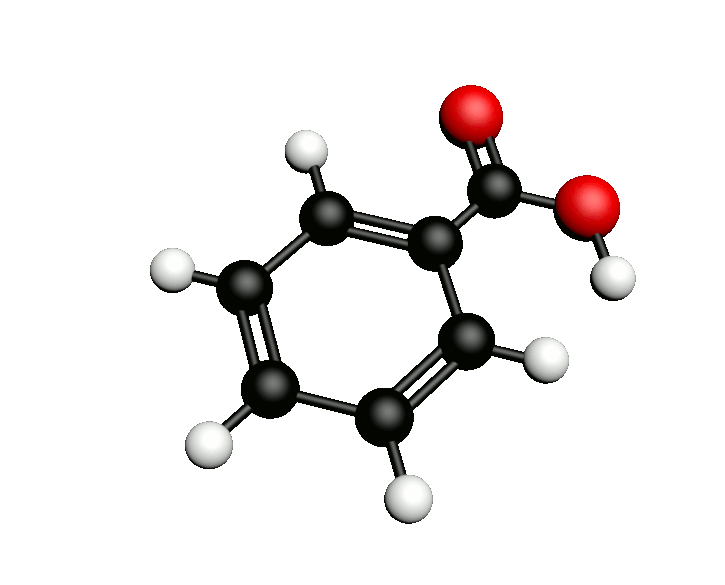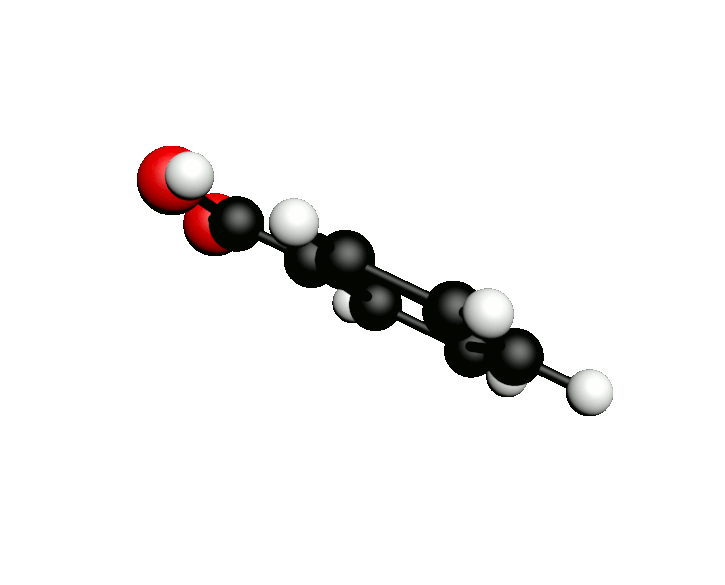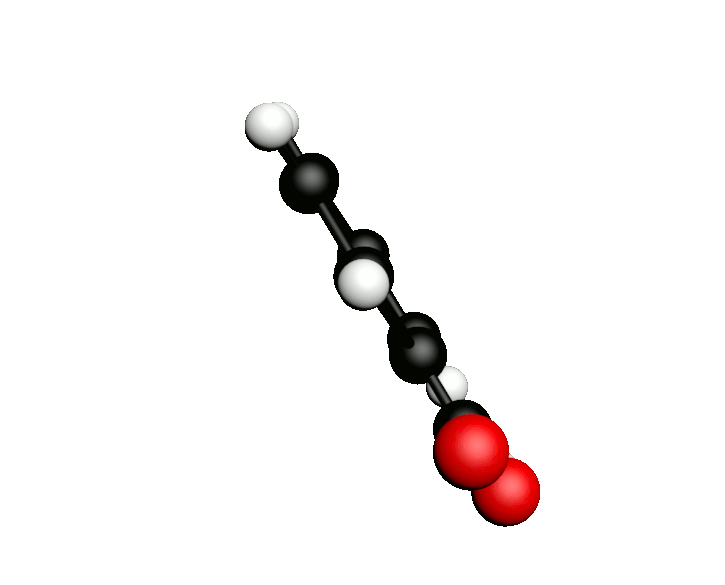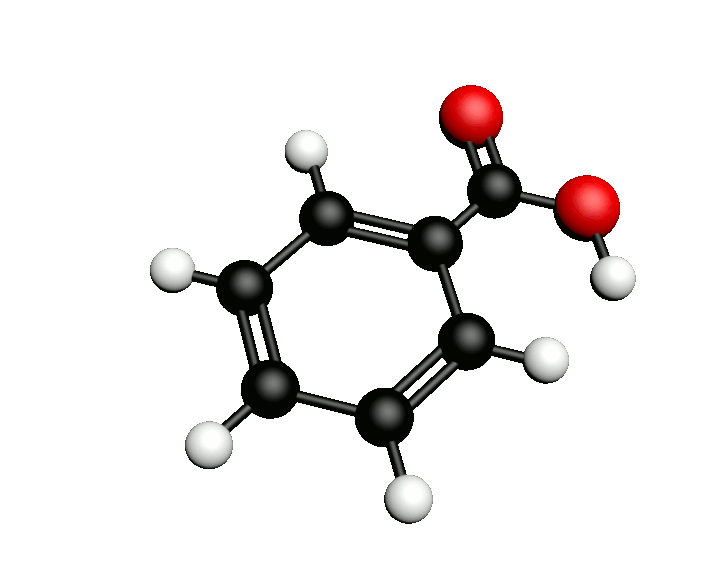
L'acide benzoïque de formule chimique C6H5COOH est utilisé en tant qu'additif alimentaire (E210) où il intervient comme conservateur. Dans l'industrie chimique c'est un précurseur d'autres conservateurs mais aussi de certains plastifiants. On peut également l'utiliser pour synthétiser l'aspirine.
Comment synthétiser l'acide benzoïque ?
|
 |
· Filtrer sur Büchner le mélange refroidi. Le filtrat doit être limpide ; si ce n'est pas le cas ajouter quelques gouttes d'éthanol. Filtrez à nouveau pour obtenir un filtrat limpide. · Recueillir le filtrat dans un bécher de 500 mL, et ajouter une solution concentrée d'acide chlorhydrique jusqu'à pH = 1 environ. Refroidir en dessous de 10°C dans un bain de glace. · Filtrer sur Büchner, rincer avec de l'eau glacée, essorer et peser : masse = m. · Mettre à sécher à température réglée à 80°C. Soit m' la masse de produit brut sec. · Identifier le produit obtenu par chromatographie sur couche mince (on prendra comme éluant un mélange cyclohexane /acétone (3/2)), ou à l'aide d'une analyse par spectrométrie infrarouge, ou à l'aide du banc de Kofler (TF,acide benzoïque = 120°C ) |
|
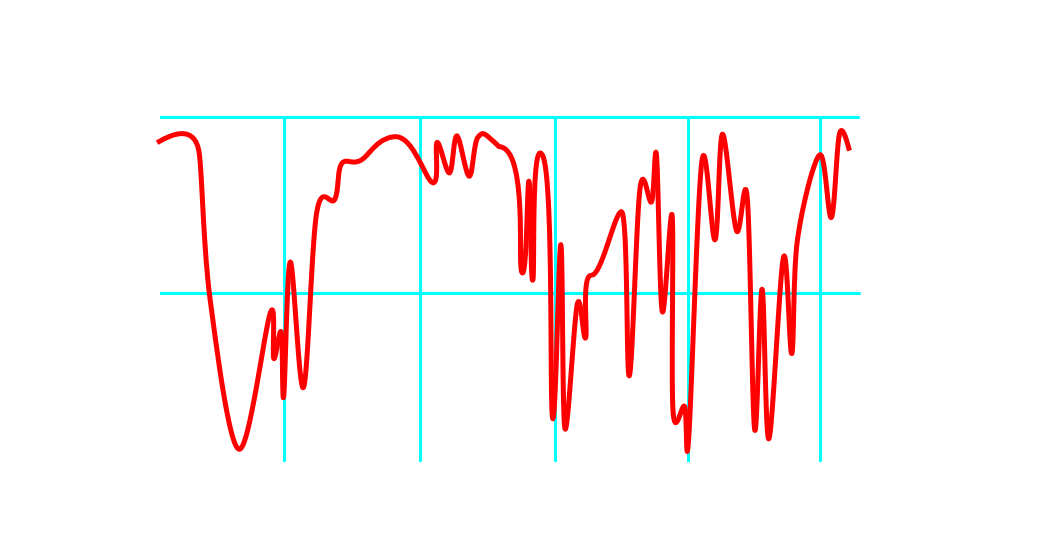
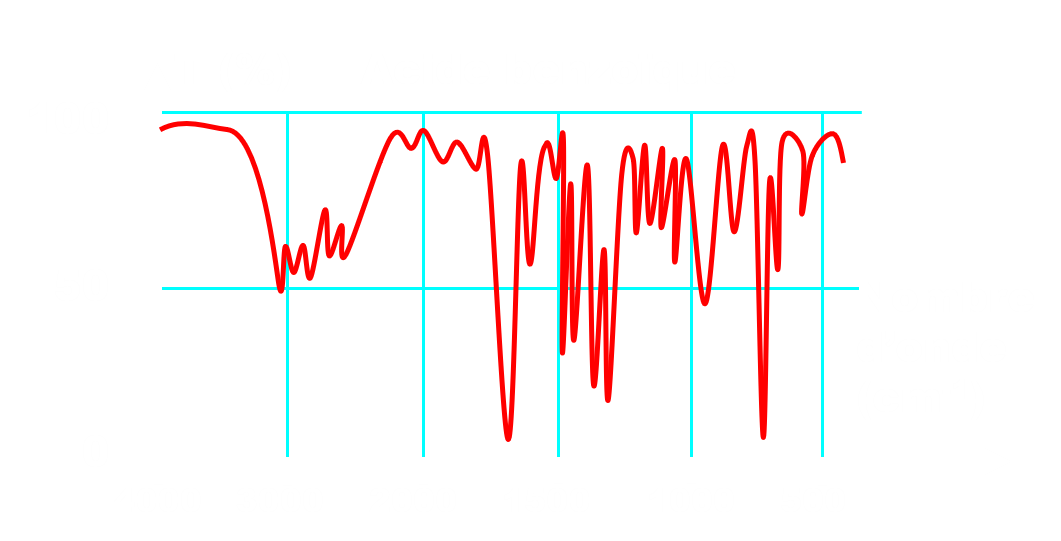
Doc.2 : Exemple de spectres IR.
|
|
Doc.3 : Couples d'oxydoréductions mis en jeu.
|
|
Doc.4 : Protocole pour la CCM.
1. Placer l'éluant [cyclohexane + acétone : mélange 3V/1V], dans la cuve et la fermer. 2. Faire 3 dépôts sur la plaque : · solution d'alcool benzylique a un pour 100 dans l'éthanol (solution fournie) ; · solution d'acide benzoïque a un pour 100 dans l'éthanol (solution fournie) ; · solution de l'acide benzoïque brut préparé à un pour 100 dans l'éthanol (solution à préparer) 3. Révéler sous la lampe UV (254 nm) |
Analyser-raisonner.
· A l’aide du doc.3, dresser le tableau d’avancement de la réaction qui modélise la transformation et déterminer quel est le réactif limitant.
· Identifier la nature de la transformation chimique utilisée pour transformer l’alcool benzylique en acide benzoïque.
· Indiquer comment la chromatographie sur couche mince permettra d’identifier et de caractériser la pureté du produit obtenu.
Réaliser.
· A l’aide du doc.2, identifier les bandes d’absorption caractéristiques des liaisons représentant la fonction alcool et la fonction acide. Indiquer comment l’analyse spectrale IR pourra nous renseigner sur la pureté du produit obtenu.
Valider.
· Indiquer la nature de la transformation chimique mise en œuvre dans ce protocole et quelles sont les techniques d’identification que l’on peut utiliser pour vérifier que la transformation d’un groupe fonctionnel a bien eu lieu.
EXERCICES : 9 ; 10 ; 11 ; 12 ; 14 ; 16 ; 18 ; 19 ; 23 ; 25 ; 29 P 219 à 225
COURS
C1. Structures et propriétés.
C11. Formule topologique.
Il s'agit d'une représentation simplifiée des molécules :
- On ne représente pas les atomes de carbone et d'hydrogène.
- Seuls les atomes d'hydrogène liés à d'autres atomes apparaissent.
- Les liaisons simples sont représentées par des segments, les doubles par deux segments.
Exemple : l'acide lactique.
acide 2-hydroxypropanoïque
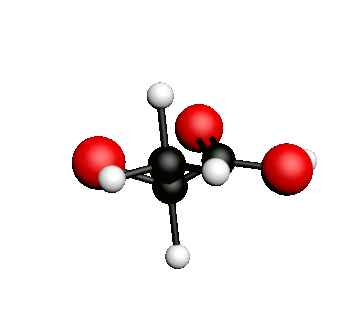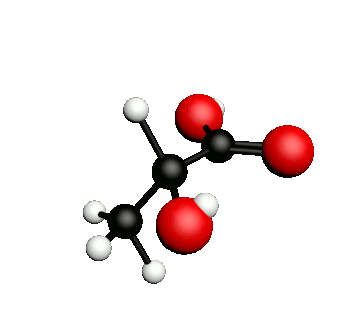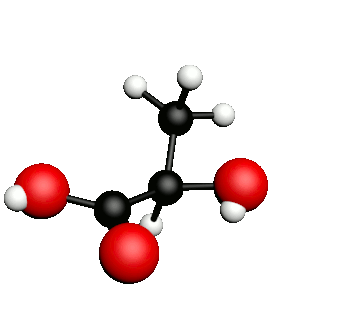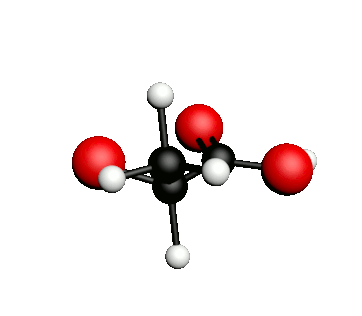 |
 |
 |
C12. Familles fonctionnelles.
| Formule | Groupement | Famille/Fonction | Exemple | ||
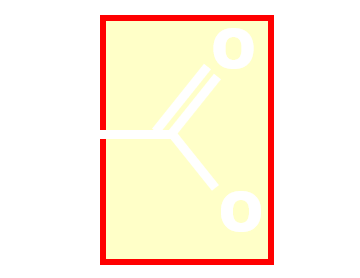 |
Carboxyle | Acide carboxylique |
|
||
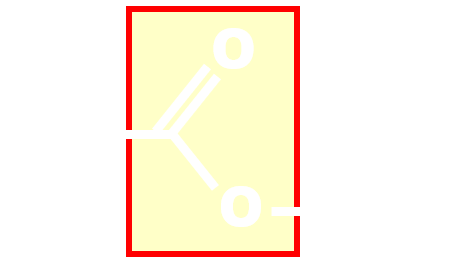 |
carboxyle | ester |
|
||
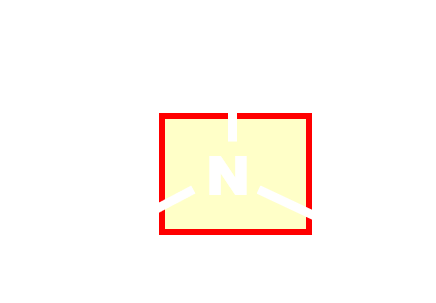 |
amino | amine |
|
||
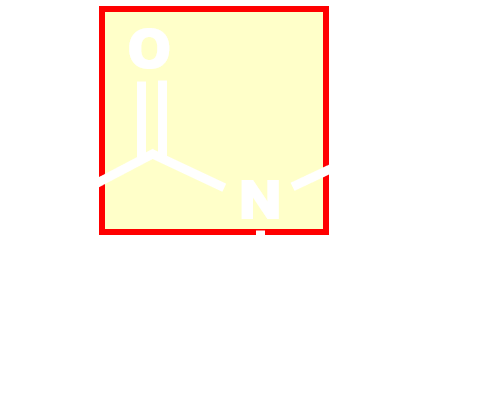 |
amido | amine |
|
||
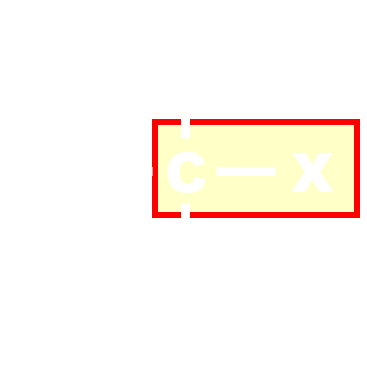 |
halogéno-alcane | alcane |
|
C13. Familles isomères de constitution.
Deux molécules sont dites isomères de constitution si :
• Elles ont la même formule brute.
• Elles ont des formules semi-développées (ou topologiques) différences.
Exemple : on considère la formule brute C3H6O2.
Donner les formules topologiques et les noms des isomères non cycliques en se limitant à des liaisons simples entre atomes de carbone.
On distingue plusieurs types d'isomères de constitution :
- Isomères de chaînes : leurs squelettes carbonés ont différents.
- Isomères de position : leurs groupes caractéristiques ou leurs insaturations sont positionnés différemment.
- Isomères de fonction : les groupes caractéristiques ne sont pas les mêmes.
C14. Polymères.
Un polymère est un matériau constitué de macromolécules de tailles différentes, mais de masses moléculaires toujours élevées et dans lesquelles un motif (monomère) se répète un très grand nombre de fois. Ils peuvent être naturels (latex, amidon) ou synthétiques (polypropylène, polystyrène…) et leurs utilisations variées.
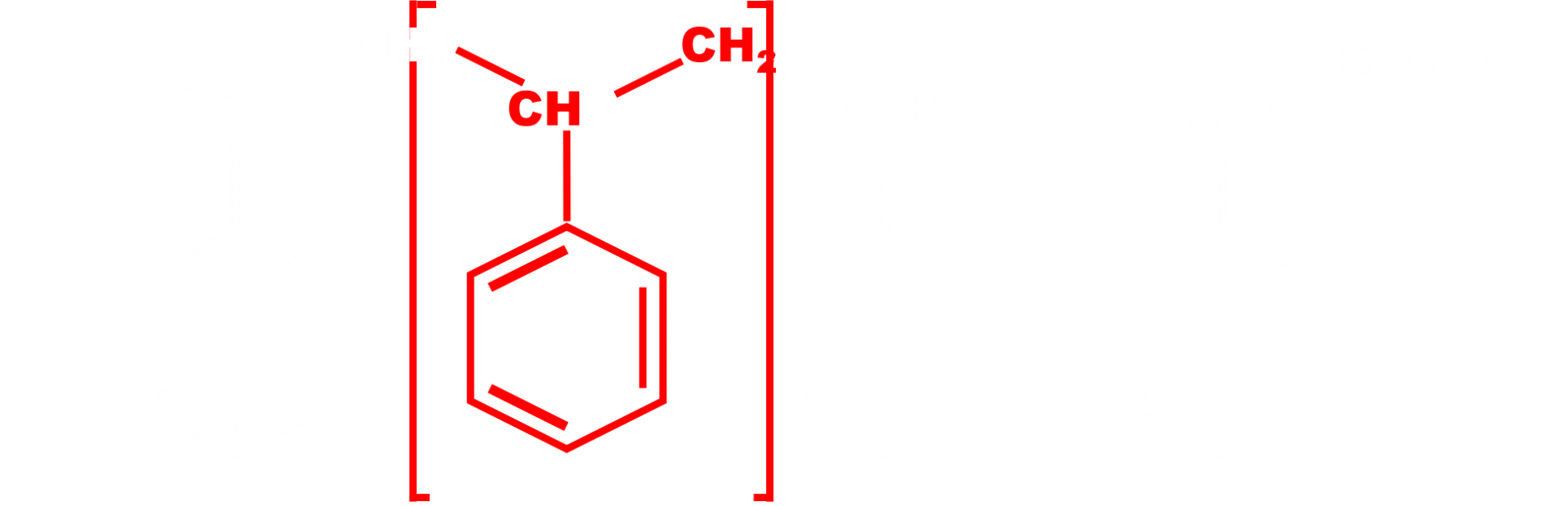 |
 |
C2. Optimisation d'une synthèse.
C21. Contrôle de la vitesse.
Augmenter la vitesse d'une réaction chimique permet de diminuer la durée donc d'augmenter la production horaire.
· Afin d'augmenter la vitesse de réaction on peut "jouer" sur différents facteurs :
- La température,
- La pression,
- La concentration,
- Les quantités de réactifs,
- Utiliser (ou pas) des catalyseurs.
· Plusieurs arguments conduisent à préférer l'utilisation d'un catalyseur plutôt que l'augmentation de la température :
- Chauffer induit un coût énergétique.
- Chauffer implique aussi un impact environnemental.
- Le catalyseur est régénéré.
- Un système chimique peut évoluer selon différentes réactions. Le choix du bon catalyseur favorisera l'évolution souhaitée (catalyse sélective).
Exemple :
Synthèse de l'éthanoate d'éthyle utilisé comme solvant pour enlever le vernis à ongles, pour les parfums à odeurs fruités, pour les composants d'arômes (fraise).
En faisant réagir 1,0 mol d'acide éthanoïque et 1,0 mol d'éthanol :
$CH_3CO_2H_{(l)} + C_2H_5OH_{(l)} \overrightarrow{\longleftarrow} CH_3CO_2C_2H_{5(l)} + H_2O_{(l)}$
Dans l'état final, on obtient 0,67 mol d'ester
|
 |
C22. Contrôle du rendement.
|
Le rendement d'une synthèse est le rapport de la quantité de matière finale $n_f$ de produit obtenu la quantité $n_{max}$ qu'on peut obtenir à partir du réactif limitant présent. $\eta = \dfrac{n_f}{n_{max}}$ |
C22a. Augmenter le rendement.
Le rendement de la synthèse augmentera en introduisant un réactif en excès : il s'agit d'un déplacement d'équilibre.
Exemple :
Considérons la synthèse suivante.
$A_{(aq)}+B_{(aq)} \overleftarrow{\longrightarrow}C_{(aq)}+ D_{(aq)}$ de constante de réaction K=1 avec des réactifs introduits
en quantités égales,$n_A=n ; n_B=n$
Le tableau d'avancement :
| Etat | Avancement | $A_{(aq)} \hspace{1 cm} + \hspace{1 cm} B_{(aq)} \hspace{1 cm} \overleftarrow{\longrightarrow} \hspace{1 cm} C_{(aq)} \hspace{1 cm} + \hspace{1 cm} D_{(aq)}$ | ||||
| Initial | 0 | $n$ | $n$ | 0 | 0 | |
| intermédiaire | $x$ | $n-x$ | $n-x$ | $x$ | $x$ | |
| final | $x_f$ | $n-x_f$ | $n-x_f$ | $x_f$ | $x_f$ | |
La quantité de matière maximale de $C$ que l'on peut obtenir est égale à l'avancement $x_{max} = n$.
Dans l'état final : $\left[ C \right]_f = \left[ D \right]_f = \dfrac{x_f}{V} et \left[ A \right]_f = \left[ B \right]_f = \dfrac{n-x_f}{V}$
La constante d'équilibre est : soit : $ K = \dfrac {x_f^2}{\left( n-x_f \right)^2 } = 1 \ donc : \ \dfrac {x_f^2}{\left ( n-x_f \right)^2} = 1 $
On en déduit le rendement : $\eta = \dfrac {n_{C,f}}{n} = \dfrac {1}{2}$
En introduisant A en excès : $n_A=2n ; n_B=n$
Le tableau d'avancement :
| Etat | Avancement | $A_{(aq)} \hspace{1 cm} + \hspace{1 cm} B_{(aq)} \hspace{1 cm} \overleftarrow{\longrightarrow} \hspace{1 cm} C_{(aq)} \hspace{1 cm} + \hspace{1 cm} D_{(aq)}$ | ||||
| Initial | 0 | $n$ | $n$ | 0 | 0 | |
| intermédiaire | $x$ | $n-x$ | $n-x$ | $x$ | $x$ | |
| final | $x_f$ | $n-x_f$ | $n-x_f$ | $x_f$ | $x_f$ | |
La quantité de matière maximale de $C$ que l'on peut obtenir est égale à l'avancement $x_{max} = n$.
Dans l'état final : $\left[ C \right]_f = \left[ D \right]_f = \dfrac{x_f}{V} et \left[ A \right]_f = \dfrac {2n-x_f}{V} \ et \ \left[ B \right]_f = \dfrac{n-x_f}{V}$
La constante d'équilibre est : soit : $ K = \dfrac {x_f^2}{\left( 2n-x_f \right) \left( n-x_f \right)} = 1 \ donc : \ \dfrac {x_f}{\left ( n-x_f \right)^2} = 1 $
soit : $x_f^2=2n^2-3n+x_f^2$
On en déduit le rendement : $\eta = \dfrac {n_{C,f}}{n} = \dfrac {2}{3}$ qui a augmenté.
C22b. Elimination des produits.
En éliminant les produits au fur et à mesure de la réaction, l'évolution se trouve "forcée" à continuer de progresser, jusqu'à disparition complète des réactifs introduits dans les conditions stoechiométriques.
C'est le cas de la synthèse d'un ester.
Retour à l'exemple de la synthèse de l'éthanoate d'éthyle :
| Etat | Avancement | $CH_3CO_2H_{(l)} + C_2H_5OH{(l)} \hspace{1 cm} \overleftarrow{\longrightarrow} \hspace{1 cm} CH_3CO_2C_2H_{5(l)} \hspace{1 cm} + \hspace{1 cm} H_2O{(l)}$ | ||||
| Initial | 0 | $n$ | $n$ | 0 | 0 | |
| intermédiaire | $x$ | $n-x$ | $n-x$ | $x$ | $x$ | |
| final | $x_f$ | $n-x_f$ | $n-x_f$ | $x_f$ | $x_f$ | |
Dans l'état final, on obtenait 0,67 mol d'ester en ne modifiant rien de la quantité de produit formé.
En supprimant l'ester, la quantité produite reste à 0 mol, et la réaction continue jusqu'à disparition totale des réactifs.
C3. Stratégie de synthèse.
C31. Synthèse d'une espèce.
Une circonscrit actionnelle est une suite de réactions chimiques permettant la synthèse d'une molécule cible à partir de réactifs. Chaque étape de la séquence peut inclure modification de groupe caractéristique, de chaîne carbonée, ou une polymérisation.
Exemples :
• Dans l'air, l'éthanol, portant le groupe hydroxyle, s'oxyde en acide éthanoïque, portant le groupe carboxyle :
$H_3C - CH_2 - OH + O_2 \overrightarrow{\longleftarrow} H_3C - O_2H + H_2O$
Il y a donc modification de groupe.
• L'isomérisation de l'heptane, lors de son reformage, forme du 2,4- diméthylpentane. Il y a donc modification de la chaîne carbonée.
$H_3C-(CH_2)_5-CH_3 \longrightarrow H_3C - CH \left ( CH_3 \right ) - CH_2 - CH \left ( CH_3 \right) - CH_3 $
• Le PVC est obtenu par polymérisation du chlorure de vinyle.
C32. Grands types de réactions.
C32a. Substitution.
Au cours d'une réaction de substitution, un atome ou groupe d'atomes de la molécule étudiée est remplacé par un autre atome ou un autre groupe d'atomes.
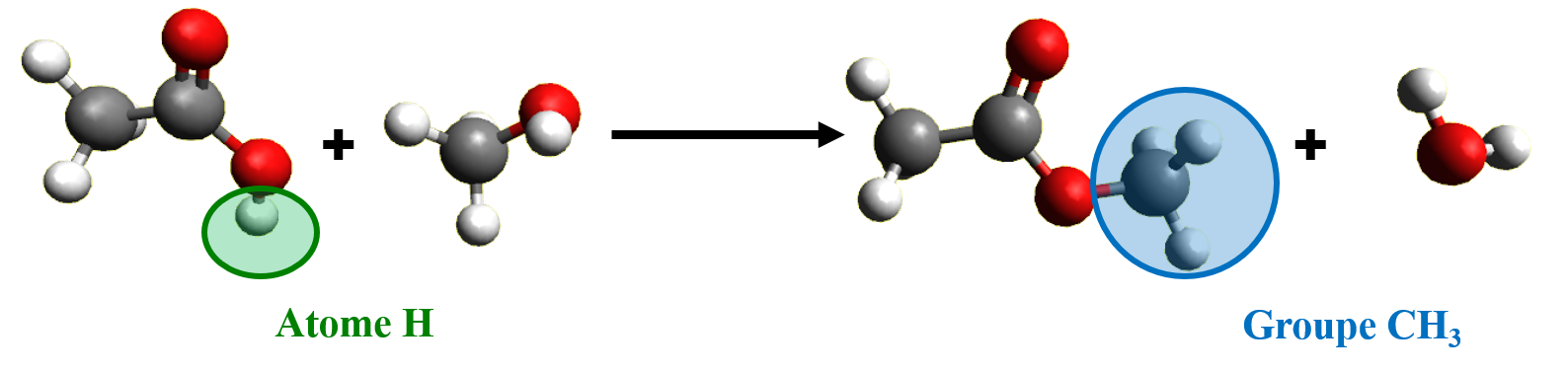
C32b. Addition.
Au cours d'une réaction d'addition, des atomes ou groupes d'atomes se lient à la molécule étudiée sans que celle-ci ne perde d'atomes.
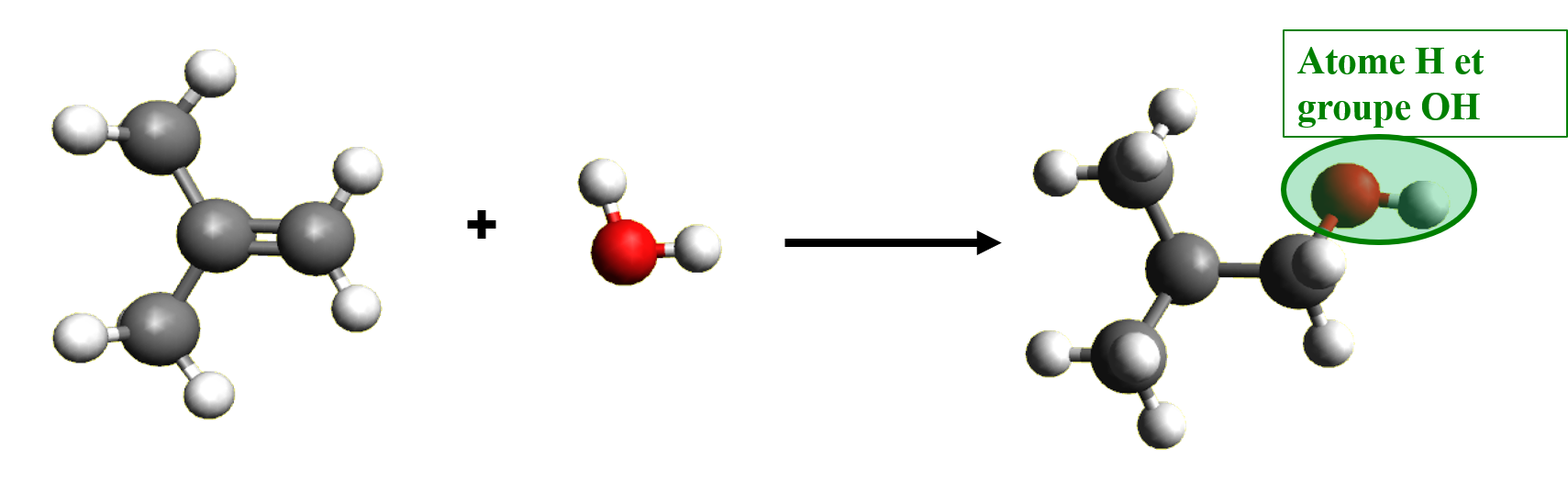
C32c. Elimination.
Au cours d'une réaction d'élimination, des atomes ou groupes d'atomes sont ôtés à la molécule étudiée sans que celle-ci ne gagne d'atomes.
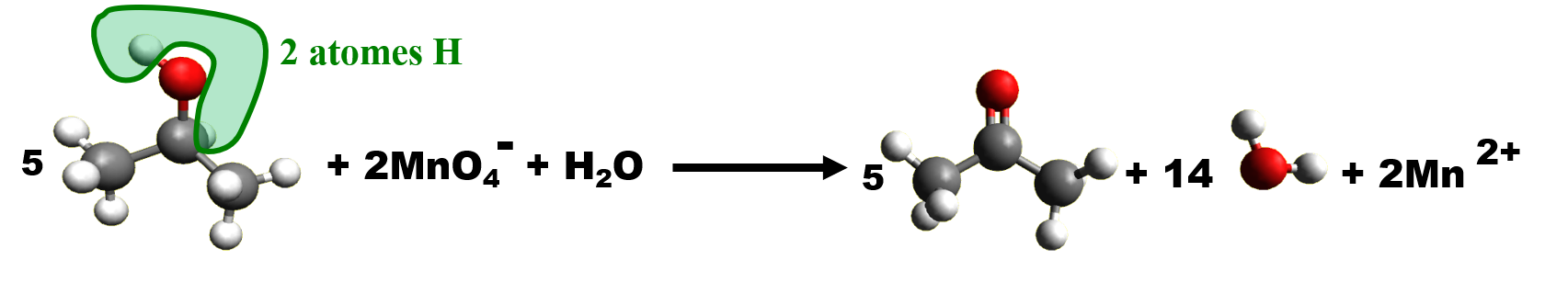
C33. Protection / déprotection.
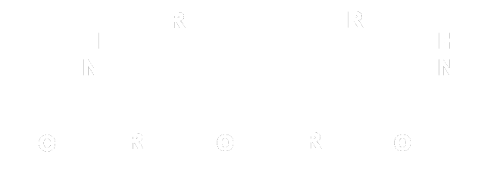
Un composé polyfonctionnel porte plusieurs groupes caractéristiques.
Chacun peut réagir avec un même réactif.
Exemple :
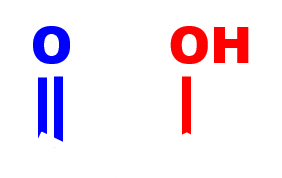
3-hydroxybutanal groupement hydroxyle groupement carboxyle |
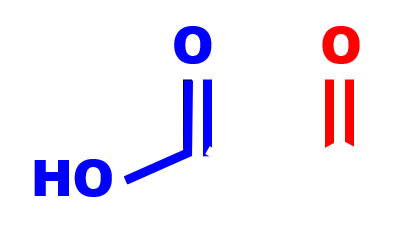
acide 3-oxobutanoïque groupement carbonyle groupement carboxyle |
L'oxydation du 3-hydroxybutanal par les ions permanganate $MnO_4^- $ donne l'acide 3-oxobutanoïque, les deux groupes ont été oxydés par les ions permanganate.
· Afin de privilégier la réaction de l'une des fonctions d'un composé bifonctionnel, on peut choisir un réactif chimiosélectif, ou empêcher qu'un réactif non chimiosélectif réagit sur l'autre.
|
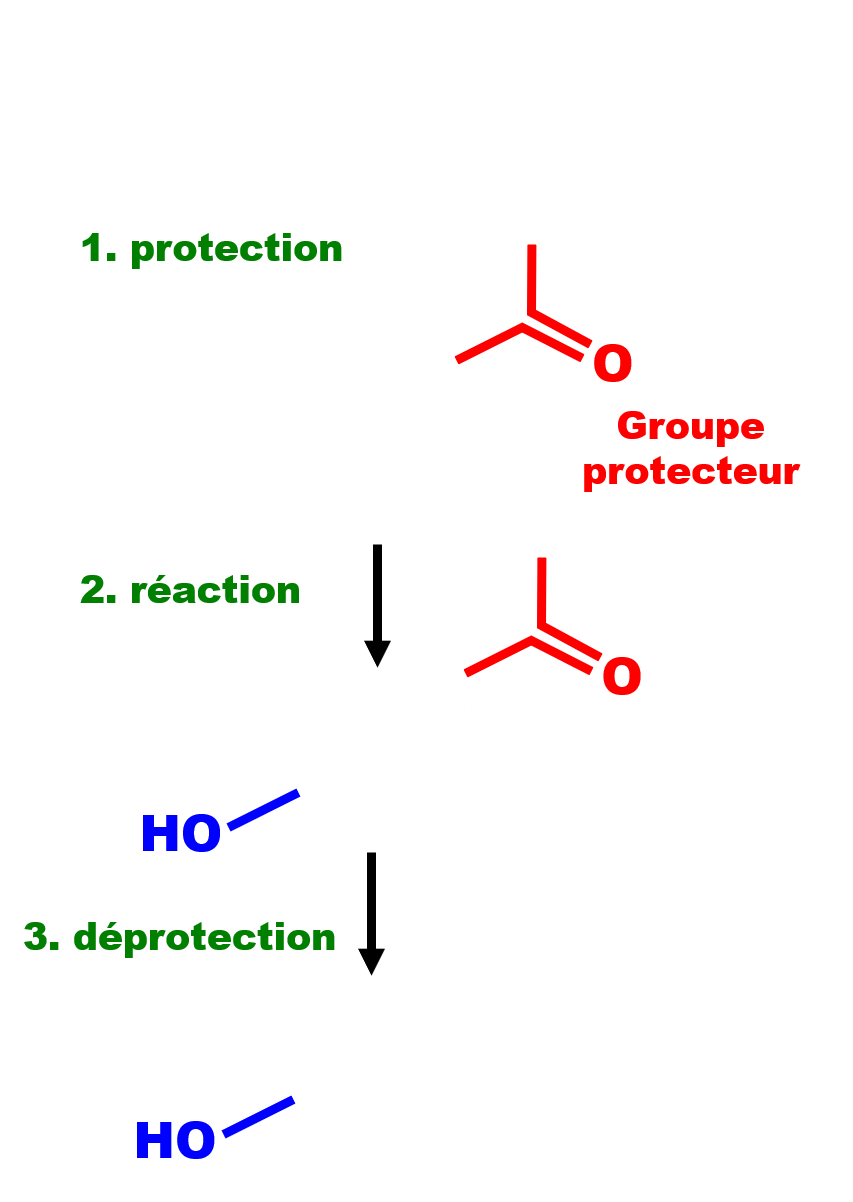
Une étape de protection est la création d'un groupe protecteur sur une des fonctions d'un composé polyfonctionnel afin de bloquer sa réactivité.
Après action du réactif sur la fonction non protégée, on réalise l'étape de déprotection de la fonction protégée.
La séquence réactionnelle est donc allongée de deux étapes.
Le groupe protecteur doit se former de façon sélective sur le groupe à protéger. Il doit être stable lors de la réaction avec le groupe à modifier. Il doit être facile à éliminer lors de la déprotection. La fonction apportée lors de la réaction doit être stable lors de la déprotection. |
 |
C34. Synthèse écoresponsable.
Les 12 principes de la chimie verte ont été développés à l’origine par des ex agents de la EPA ( l’agence américaine de protection de l’environnement ), Paul Anastas et John Warner, dans Green Chemistry: Theory and Practice. Ces principes tracent la feuille de route pour les chimistes en vue d’instaurer une logique chimie verte dans leurs actions.
Ajouter un commentaire