Tranformation Acide-Base
ACTIVITES
A1 : Définir un acide et une base.
Il existe différentes définitions pour un acide et une base.
Suivant les réactifs utilisés et le milieu d'étude, une définition sera plus ou moins adaptée à la situation.
|
Doc1 : évolution de la définition.
|
• En quoi la définition de Boyle est-elle différente des autres définitions ?
• Écrire les équations qui selon Arrhenius se produisent lorsque l’on met l’acide nitrique $HNO_{ \ 3 (l)} ou de l’hydroxyde de calcium $Ca \left ( OH \right )_{2(s)}$ dans de l’eau.
• Donner un inconvénient de la définition d’Arrhenius.
• Quels sont les points communs et les différences entre les définitions d'Arrhenius et de Brønsted ?
• Écrire les équations qui selon Brønsted décrivent le comportement de l’acide ascorbique (ou vitamine C) $C_6H_8O_6$ et de l’ion carbonate $\ CO_{3\left ( aq \right )}^{2-} $
• Comment les définitions d’acides et de bases ont évoluer au cours du temps.
A2 : Réaction Acide-Base. (classe inversée).
Comment modéliser une transformation Acide-Base selon la définition de Brønsted ?
|
|
Observation n°1 :
• Quels sont les réactifs de la réaction décrite ? Préciser leur état physique et identifier l’espèce chimique qui joue le rôle d’acide et celle qui joue le rôle de base.
• Écrire les 2 couples acide-base mis en jeu et en déduire les 2 équations acide-base.
• Établir l’équation de la réaction acide-base décrite.
Observation n°2 :
• Sachant que les ions chlorure $\ Cl_{\left ( aq \right )}^{-} $ et les ions sodium $\ Na_{\left ( aq \right )}^{+} $ sont des ions spectateurs et que le produit obtenu se forme en phase aqueuse, reprendre les questions de l’observation n°1.
• Comment expliquer l’apparition de l’odeur d’ammoniac ?
Synthèse :
• Expliquer pourquoi la demi-équation acide-base s’écrit avec $ \overrightarrow{\longleftarrow}$.
• Comment modéliser une transformation acide-base .
A3 : Schéma de Lewis d'un couple Acide-Base.
Comment passer de la représentation de Lewis de la forme acide d'un couple à celle de la base conjuguée et inversement ?
|
|
|
Doc 4 : Extrait de la classification. |
EXERCICES : 10,11,12,15,17, 19, 21, 23, 24, 26, 27, 29, 32, 35, 36, 40, 42 de la page 27 à la page 37.
Et réponses aux activités.
COURS
C1 :Les acides et les bases.
C11 : Selon Brønsted.
C11a : Acide.
|
Un acide est une espèce chimique capable de libérer au moins un ion hydrogène H +. L'acide AH se transforme alors en sa base conjuguée A -.
$\begin{matrix} |
Exemple : En cédant un ion hydrogène $\space H^{+}$ l'acide éthanoïque CH3CO2H(aq) se transforme en ion éthanoate $\color{#00ff00}{ CH_{3}CO_{2\left ( aq \right )}^{-}}$ :
$\begin{matrix}
\color{blue}{CH_3CO_2}\color{red}{H_{(aq)}} & \longrightarrow & \color{#00ff00}{CH_3CO^{-}_{2(aq)}} & + & \color{red}{H^+}
\\
\color{blue}{Acide} & & \color{#00ff00}{Base} & & \color{red}{Ion \ Hydrogène}
\end{matrix}$
C11b : Base.
|
Une base est une espèce chimique capable de capter au moins un ion hydrogène H +. La base A - se transforme alors en son acide conjugué AH. $\begin{matrix} |
Exemple : En captant un ion hydrogène $\space H^{+}$ , l'ion éthanoate $\color{#00ff00}{CH_{3}CO_{2\left ( aq \right )}^{-}}$ se transforme en acide éthanoïque CH3CO2H(aq) :
$\begin{matrix}
\color{#00ff00}{CH_3CO^{-}_{2(aq)}}& + & \color{red}{H^+} & \longrightarrow & \color{blue}{CH_3CO_{2}}\color{red}{H_(aq)}
\\
\color{#00ff00}{Base} & & \color{red}{Ion \ Hydrogène} & & \color{blue}{Acide}
\end{matrix}$
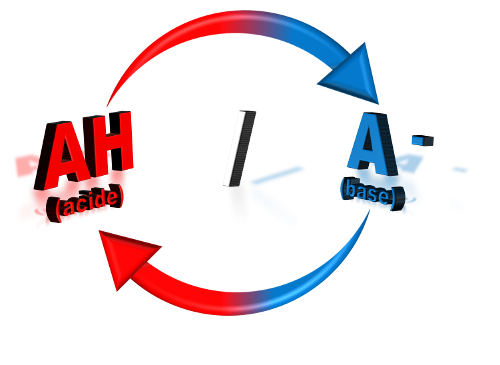
C12 : Couple acide-base.
|
L'acide AH et la base conjuguée A- forment un couple acide-base noté AH / A – . Il y a transfert d'un ion hydrogène H +. La demi-équation du couple s'écrit : $\begin{matrix}
|
NB : le signe  signifie que le transfert de l'ion hydrogène peut avoir lieu dans les deux sens.
signifie que le transfert de l'ion hydrogène peut avoir lieu dans les deux sens.
Exemples à connaître :
· acide carboxylique / ion carboxylate : $RC_2OH_{(aq)} / RCO^-_{2(aq)}$
· ion ammonium / amine : $RNH^+_{3(aq)} / RNH_{2(aq)}$
· acide carbonique /ion hydrogénocarbonate : $CO_2,H_2O_{(aq)} / HCO^-_{3(aq)} $
· ion hydrogénocarbonate / ion carbonate : $HCO^-_{3(aq)} / CO^{2-}_{3(aq)}$
C13 : Notation.
C14 : Espèce amphotère.
|
C'est une espèce à la fois l'acide d'un couple et la base d'un autre couple. |
Exemple fondamental : L'eau.
• En tant que base : $H_3O^+_{(aq)} / H_2O_{(l)} \ , \ H_2O_{(l)} + H^+ \overrightarrow{\longleftarrow} H_3O^+_{(aq)}$
• En tant qu'acide : $H_2O_{(l)} / HO^-_{(aq)} \ , \ H_2O_{(l)} \overrightarrow{\longleftarrow} HO^-_{(aq)} + H^+ $
C15 : Lien avec la représentation de Lewis.
La formule semi-développée ou bien le schéma de Lewis de l'entité acide ou basique permet de comprendre son processus de formation.
acide carboxylique / ion carboxylate : $RCO_2H_{(aq)} / RCO^-_{2(aq)} $
ion ammonium / amine : $RNH^+_{3(aq)} / RNH_{2(aq)} $
C2 :La réaction acide-base.
Considérons deux couples $A_1\color{red}{H}_{(aq)} / A^-_{1(aq)} \ \ et \ \ A_2\color{red}{H}_{(aq)} / A^-_{2(aq)} $ :
$\underline{ \begin{matrix} A_1\color{red}{H_{(aq)}} \ \ \ \ \ \overrightarrow{\longleftarrow} A^{-}_{1(aq)} + \color{red}{H^+} \\ A^{-}_{2(aq)} \color{red}{H^+} \overrightarrow{\longleftarrow} A_2\color{red}{H_{(aq)}} \end{matrix} } $
$\begin{matrix} A^{-}_{2(aq)} + A_1\color{red}{H}_{(aq)} \overrightarrow{\longleftarrow} A^{-}_{1(aq)} + A_2 \color{red}{H_{(aq)}} \end{matrix}$
NB : La réaction peut être considérée comme un échange d'ion H +.
Exemple: Action de l'acide éthanoïque du couple $\color{red}{CH_3CO_2H_{(aq)}} / CH_3CO^-_{2(aq)}$ sur l'ammoniac du couple $NH^+_{4(aq)} / \color{blue}{NH_{3(aq)}}.$
$\underline{ \begin{matrix} & &\color{red}{CH_3CO_2H{(aq)}}& \overrightarrow{\longleftarrow} & CH_3CO^{-}_{2(aq)} & + & \color{red}{H^+} \\ \color{blue}{NH_{3(aq)}} & + & \color{red}{H^+} & \overrightarrow{\longleftarrow} & NH^+_{4(aq)} & & \end{matrix}} \\ \begin{matrix} \color{blue}{NH_{3(aq)}} & + & \color{red}{CH_3CO_2H{(aq)}} &\overrightarrow{\longleftarrow} & CH_3CO^{-}_{2(aq)} & + & NH^+_{4(aq)} \end{matrix} $
C3 : Le pH d'une solution.
|
Le pH d'une solution (potentiel Hydrogène) est un indicateur d'acidité lié à la présence des ions oxonium $ H_3O^+_{(aq)}$ en solution.
• c0 est la concentration standard : c0 = 1 mol.L-1 • le pH se mesure avec un pH-mètre. • le pH augmente si $\left [ H_3O^+ \right ] $ diminue et inversement. • le pH permet de déterminer la concentration en ions oxonium :
|
Ajouter un commentaire